Séquençage
La Lp(a) correspondant à une LDL contenant en
plus l'apoprotéine (a), on a attribué à cette
dernière le pouvoir athérogène particulier de la
lipoprotéine entière.
Le caractère athérogène de la
Lp(a) est resté une énigme, jusqu'au séquençage de
l'apolipoprotéine(a) et de son ADN (cDNA) par une équipe de
chercheurs de la firme Genetech, qui met en
évidence une étroite homologie de structure avec le
plasminogène, enzyme responsable de la fibrinolyse.
Le plasminogène est une glycoprotéine
simple chaîne de 791 acides aminés et de poids moléculaire
92 000 Da, contenant 2 p.cent d'hydrates de carbone. Elle est constituée
de plusieurs régions structurales avec, à partir de
l'extrémité N-terminale: un peptide de préactivation suivi
de 5 domaines (numérotés de 1 à 5) comprenant 78 à
82 acides aminés dont 6 restes cystéine et unis entre eux par de
courtes séquences de liaison. Les 6 cystéines forment 3 ponts
disulfures dans chaque domaine (entre les cystéines 1 et 6, 2 et 4, 3 et
5) responsables de leur structure tertiaire en triple boucle définissant
les domaines de type kringle. Ces 5 domaines en
boucles présentent des homologies entre eux. A l'extrémité
C-terminale il y a un domaine protéase de type trypsine.
Le séquençage de l'apo(a)
116, et celui du cDNA de l'apo(a)
126 révèlent une importante homologie
de séquence avec le plasminogène, sérine protéase
plasmatique responsable de la fibrinolyse (Figure 12).
Thèse Docteur Pharmacie La lipoprotéine Lp(a) :
son intérêt dans l'interprétation du bilan lipidique Dr
GUIMONT MC 78/271 Lipides, Lipoprotéine (a),
Hyperlipoprotéinémie, Athérosclérose, Lipids,
Lipoprotein, Lpa, Hyperlipoproteinemia, Atherosclerosis
Les diverses régions codantes et non codantes
du gène de l'apo(a) ont un pourcentage d'identité allant de 75
à 100 p.cent avec les régions correspondantes dans le gène
du plasminogène 130
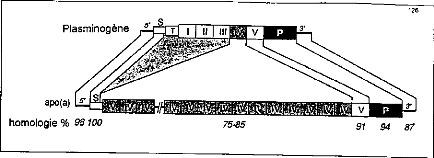
Figure 12 : Homologie de séquence des cDNA de
l'apo(a) et du plasminogène Le séquençage de
l'apoprotéine (a) montre que la séquence N-terminale est
homologue au kringle 4 du plasminogène, qu'il existe un kringle 5 et que
les domaines protéases des deux protéines présentent une
importante homologie.
Le plasminogène est activé par
l'activateur tissulaire du plasminogène (t-PA), par clivage au niveau
d'un reste arginine situé dans la séquence
d'activation.
La séquence d'activation de
l'apoprotéine(a) diffère de celle du plasminogène :
Lys-Cys-Pro-Gly-Arq-Val-Val-Gly-Gly , pour le plasminogène
Lys-Cys-Pro-Gly-Ser-lleu-Val-Gly-Gly , pour l'apo(a)
Pour Eaton cette mutation Arg -* Ser rend
l'apoprotéine(a) non activable en enzyme par le t-PA, activateur
physiologique du plasminogène ou par l'urokinase
116.
L'homologie de séquence a été
confirmée par l'analyse des cDNA du plasminogène et de l'apo(a)
126.
Ainsi l'apo(a) est dépourvue des 3 premiers
domaines du plasminogène, elle possède n copies du
kringle 4 (n allant de 11 à plus de 50 selon les isoformes),
une copie du kringle 5, un domaine protéase et une séquence
d'activation.
Le cDNA séquencé par Mc Lean code pour
une apoprotéine(a) de poids moléculaire 500 kDa, comprenant 37
copies du kringle 4. Il existe une très forte homologie
intra-génique dans l'apoprotéine(a) puisque sur les 37 copies des
342 paires de bases des kringles 4, 24 ont la même séquence
nucléotidique, 4 en sont très proches avec seulement 3
nucléotides différents et les autres diffèrent par 11
à 71 nucléotides.
Le 33ème kringle 4 a une
délétion de 24 bases et le 36ème kringle 4 possède
une cystéine supplémentaire, impliquée dans la liaison
avec l'apoB.
Thèse Docteur Pharmacie La lipoprotéine Lp(a) :
son intérêt dans l'interprétation du bilan lipidique Dr
GUIMONT MC 79/271 Lipides, Lipoprotéine (a),
Hyperlipoprotéinémie, Athérosclérose, Lipids,
Lipoprotein, Lpa, Hyperlipoproteinemia, Atherosclerosis
Chaque domaine de type kringle de l'apo(a) est
précédé et suivi par un peptide, l'ensemble
s'étendant sur 114 acides aminés (Figure 13). L'union des
peptides de début et des peptides de fin constitue les régions
"inter-kringles".
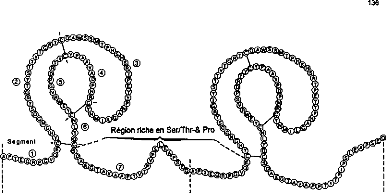
Le kringle "élargi" est divisé en 7
segments : le segment 1 est le peptide de tête et comprend 11 acides
aminés, suivi des segments 2 à 6 qui constituent le kringle
proprement dit comprenant 78 ou 80 acides aminés et enfin le segment 7
ou peptide de fin qui comporte 25 acides aminés.
I
Région riche en Ser/Thr-& Pro
136
Kringle Kringle
Figure 13 : Structures des kringles et du domaine
inter-kringles
Les régions riches en sérine,
thréonine et proline correspondent aux segments 7 et 1 donc aux
régions inter-kringles. Ces régions ont une ressemblance avec les
régions riches en thréonine et proline retrouvées dans les
glycoprotéines d'adhésion et dans les immunoglobulines
135.
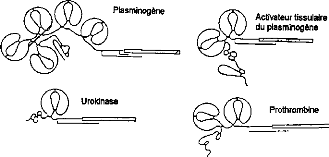
Des structures en kringle existent dans diverses
protéines de la coagulation et de la fibrinolyse (plasminogène,
prothrombine, t-PA, urokinase, facteur XII) et dans d'autres protéines
comme la fibronectine (Figure 14) 141
Thèse Docteur Pharmacie La lipoprotéine
Lp(a) : son intérêt dans l'interprétation du bilan
lipidique Dr GUIMONT MC 80/271 Lipides, Lipoprotéine (a),
Hyperlipoprotéinémie, Athérosclérose, Lipids,
Lipoprotein, Lpa, Hyperlipoproteinemia, Atherosclerosis
141
Activateur tissulaire du plasminogène
Urokinase
Figure 14 : Structures comparées du
plasminogène, du t-PA, de l'urokinase
et de la prothrombine
Les kringles des protéines impliquées dans
la coagulation et la fibrinolyse contiennent de 78
à 82 acides aminés 135.
L'homologie de l'apoprotéine(a) avec le
plasminogène la distingue de toutes les autres apolipoprotéines
connues. Sept apoprotéines (A-I, A-II, IV, C-I, C-II, C-III et E) ont
dans leurs gènes des séquences apparentées, et dans leurs
structures des régions en hélice alpha amphiphiles similaires .
Les apoprotéines B et D ne sont pas apparentées à ce
groupe.
Polymorphisme de taille
Utermann a montré que l'apoprotéine(a)
présente un important polymorphisme de taille. Par la technique du
western blotting il met en évidence 6 isoformes d'apoprotéine(a)
différentes avec des masses moléculaires allant de 280 à
800 kDa (Tableau XIII). Chaque individu présente une ou deux isoformes
distinctes donnant lieu à une quinzaine de phénotypes
possibles.
De plus, il existe une association entre le
phénotype d'apoprotéine(a) et la concentration de
Lp(a) 131 132
Les variations de taille de l'apo(a) résultent
d'ARN messagers de taille différente avec une relation linéaire
et positive entre la taille des transcrits et la taille des protéines
correspondantes déterminée par immunoblotting.
Les variations de taille de l'apo(a) apparaissent
donc dues à des allèles différant par le nombre des
répétitions en tandem, des séquences de 114 acides
aminés homologues au kringle 4 du plasminogène 133
Hixson avait obtenu des résultats similaires chez
le Babouin 134
Thèse Docteur Pharmacie La lipoprotéine Lp(a) :
son intérêt dans l'interprétation du bilan lipidique Dr
GUIMONT MC 81/271 Lipides, Lipoprotéine (a),
Hyperlipoprotéinémie, Athérosclérose, Lipids,
Lipoprotein, Lpa, Hyperlipoproteinemia, Atherosclerosis
Thèse Docteur Pharmacie La lipoprotéine Lp(a)
: son intérêt dans l'interprétation du bilan lipidique Dr
GUIMONT MC 82/271 Lipides, Lipoprotéine (a),
Hyperlipoprotéinémie, Athérosclérose, Lipids,
Lipoprotein, Lpa, Hyperlipoproteinemia, Atherosclerosis
Ainsi le polymorphisme est sous contrôle
génétique et est lié à la longueur des
chaînes polypeptidiques et non pas à un degré variable de
glycosylation.
En effet, l'action de la neuraminidase (qui
élimine l'acide sialique) n'altère pas
l'hétérogénéité de l'apo(a)
116.
Kratzin étudie une isoforme
d'apoprotéine(a) de poids moléculaire 570 kDa et montre que les
domaines de type kringle de l'apoprotéine(a) sont unis par des
séquences de liaison (inter-kringle) plus longues (36 a.a.) que celle
qui unit les kringles 4 et 5 du plasminogène (26 a.a.) 135
Les hydrates de carbone sont répartis le long
de la chaîne d'apo(a) sous forme de liaisons O- et N- glycosidiques. Au
niveau des séquences inter-kringles, il existe 6 sites potentiels de
0-glycosylation (4 thréonines et 2 sérines) et au sein de chaque
kringle, un site de N-glycosylation (Asn, Leu, Thr).
Il y a donc un grand nombre de sites
théoriques de glycosylation (70 à 350) selon les isoformes) mais
on ne sait pas lesquels sont réellement glycosylés
136
Les régions inter-kringles ressemblent
à des séquences existant dans d'autres protéines comme la
chaîne a de la glycoprotéine lb de la membrane
plaquettaire, les chaînes légères d'IgG. Plusieurs courtes
séquences dans les régions inter-kringles sont similaires
à des séquences présentes dans des molécules
d'adhésion intercellulaires. De plus le plus petit motif
d'adhésion "Arg - Gly - Asp", présent dans de nombreuses
macromolécules impliquées dans la thrombose est également
présent dans le kringle 4-10 de l'apo(a) 136.
Plusieurs isoformes d'apo(a) ont été
décrites avec des masses moléculaires allant de 280 à 800
kDa. L'électrophorèse sur gel de polyacrylamide-SDS en
présence de R-mercaptoéthanol suivie d'un
western blotting a permis à Utermann de définir 6 isoformes qui
ont été nommées en fonction de leur mobilité
respective par rapport à celle de l'apoB100 : Lp(a)-F, Lp(a)-B,
Lp(a)-S1, Lp(a)-S2, Lp(a)-S3, Lp(a)-S4 131.
L'isoforme F (F pour fast) a une
mobilité supérieure à celle de l'apoB100, l'isoforme B a
une mobilité égale à celle de l'apoB100, et les isoformes
S1 à S4 (S pour slow) ont une mobilité
décroissante et inférieure à celle de l'apoB100 (Figure
15).
A mesure de l'augmentation de sensibilité des
méthodes de phénotypage, un plus grand nombre d'isoformes
d'apo(a) est mis en évidence. Gaubatz sépare 11 isofomes
132 , Kamboh distingue 23 isoformes 137 ,
et Marcovina parvient à une résolution au kringle
près en révélant 34 isoformes d'apo(a) différant
entre eux par
un seul kringle 4 (Figure 16)
138.
Tableau XIII : Poids moléculaires et nombre de
kringles des isoformes
d'apoprotéine(a)

Figure 16 : Les 34 isoformes d'apoprotéine (a)
mise en évidence par Marcovina
Les analyses au niveau moléculaire d'isoformes
d'apo(a), ont permis d'affiner la connaissance de la structure primaire.
Thèse Docteur Pharmacie La lipoprotéine Lp(a) :
son intérêt dans l'interprétation du bilan lipidique Dr
GUIMONT MC 83/271 Lipides, Lipoprotéine (a),
Hyperlipoprotéinémie, Athérosclérose, Lipids,
Lipoprotein, Lpa, Hyperlipoproteinemia, Atherosclerosis
On distingue ainsi 10 types de kringles 4 nommés T1,
T2, ... à T10, très homologues entre eux à de
légères différence de séquence près. Leur
homologie avec le kringle 4 du plasminogène va de 75 à 85
p.cent.
Dans chaque apo(a) il y a un seul kringle 4-T1 suivi de 3
à plus de 40 kringles 4-T2, puis les kringles 4-T3 à T10, chacun
présent en un seul exemplaire comme le kringle 4-T1, et enfin un K5-T11.
Le kringle 4-T9 contient une 7ème cystéine, non appariée
et responsable de la liaison disulfure entre l'apo(a) et l'apoB (Figure 17).
Lackner a récemment démontré que c'est
le nombre de copies du kringle 4-T2 qui supporte
l'hétérogénéité de taille de l'apo(a)
14O
Il existe 2 types de kringle 4-T2 (A et B ), dont la
séquence d'acides aminés est identique mais qui diffèrent
légèrement par leur séquence nucléotidique 136
p
-{~ IAIAIAIAIAIAIAIA[AIAIAIAIAIAIAIAIAIAIAIAIAIAI8IAtAIaI8IBI
I I Y1 I h`I Iv.-
1 2
S 1 1 4444444 10 II 11 U 14 11 14 17 I. 1. 70 71 17 77
I. IS i. 7, I. 21 10 11 12 11 14 11 It 17
3 4 5 G 7 8 9 10 K-4Type
Apo(a)-c DNA
La ligne supérieure représente les 38 kringles de
l'apo(a) séquencée par McLean, la ligne inférieure
désigne les 10 types de kringle 4 différant par leur
séquence d'acide aminés.
Figure 17 : Structure schématique du cDNA de
l'apoprotéine (a)
Il existe cependant d'importantes différences entre
l'apo(a) et le plasminogène :
- la taille : le poids moléculaire du plasminogène
est beaucoup plus faible (92 kDa) que celui
de l'apo(a) (280 à 800 kDa),
- l'apo(a) est dépourvue des kringles 1, 2 et 3 du
plasminogène,
- les kringles 4 de l'apo(a) possèdent des sites de
N-glycosylation absents du kringle 4 du
plasminogène,
- l'apo(a) contient 30 p.cent de sucre, le plasminogène 2
à 4 p.cent,
- l'apo(a) est dépourvue du site d'activation qui permet
au plasminogène d'être activé en
plasmine.



