II.3.2.5. Poids corporels
Tous les animaux ont été pesés peu de
temps avant le début du traitement, puis tous les 7 jours, et enfin le
jour du sacrifice. Les variations pondérales hebdomadaires
étaient calculées et enregistrés. La formule
utilisée pour le calcul était :
|
- GP = gain pondéral (%)
|
|
- Pn = nième mesure du poids
corporel
|
|
- Pn-1 = (n-1)ième mesure du poids
corporel
|
|
- n est une valeur entière ; 1 = n = 5
|
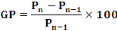
II.3.2.6. Hématologie et biochimie clinique
Les animaux ont été mis à jeun durant la
nuit qui a précédé la prise de sang. A la fin de la
période d'essai, des échantillons de sang arteroveineux ont
été prélevés au cours du sacrifice des animaux, une
partie dans des tubes à héparine, et l'autre partie dans des
tubes secs de 5 ml. Le sang contenu dans ces derniers a été
centrifugé pour obtenir le sérum. Avec le sang contenu dans les
tubes à héparine, les examens hématologiques de
Numération Formule Sanguine (NFS) ont été
effectués : hématocrite, concentration d'hémoglobine,
numération des érythrocytes et des réticulocytes,
numération et formule leucocytaire, numération des plaquettes. Le
sérum obtenu a été utilisé pour des dosages
biochimiques, effectués conformément aux protocoles fournis
avec les kits commerciaux Fortress
Diagnostics révisés en octobre 2007. Il s'agit:du
cholestérol total, du HDL-cholestérol, des triglycérides,
de la créatinine, de la bilirubine totale, de l'alanine
aminotransférase (ALAT), et de l'aspartate aminotransférase
(ASAT). Les protéines totales ont aussi été dosées,
à l'aide de la méthode du Biuret décrite par Gornall et
al., (1949).
Ø Dosage du cholestérol
total
-Principe du test : Le cholestérol est
présent dans le sérum sous la forme d'esters de
cholestérol et de cholestérol libre. Les esters de
cholestérol présents dans le sérum sont hydrolysés
par la cholestérol-esterase puis le cholestérol est mesuré
en l'oxydant avec la cholestérol-oxydase pour produire du peroxyde
d'hydrogène. Le peroxyde d'hydrogène à son tour
réagit avec le phénol et le 4-amino-antipyrine en présence
de la peroxydase pour produire la quinoneimine à coloration rouge.
L'intensité de la coloration produite est directement proportionnelle
à la concentration de cholestérol dans l'échantillon.
- Réactifs
|
Tampon :
|
50 mmol/l
|
|
Cholestérol oxydase :
|
> 100 UI
|
|
Cholestérol Estérase :
|
> 150 UI
|
|
4-aminoantipyrine :
|
0,3 mmol/l
|
|
Péroxydase :
|
> 800 UI
|
|
Phénol :
|
6,0 mmol/l
|
|
Standard Cholestérol :
|
200 mg/dl
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit :
|
|
Réactif blanc
|
Standard/Echantillon
|
|
Eau distillée
|
10 ul
|
-
|
|
Standard/Echantillon
|
-
|
10 ul
|
|
Réactif
|
1000 ul
|
1000 ul
|
|
Les préparations ont été
homogénéisées puis incubées pendant 10 minutes
à 20-25°C. Puis l'absorbance des standard et échantillons a
été lue contre celle du réactif blanc.
|
- Calcul de la concentration de cholestérol:
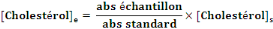
- [cholestérol]e : Concentration de
cholestérol dans l'échantillon
- [Cholestérol]s : Concentration de
cholestérol dans le standard
- abs : mesure de l'absorbance
Ø Dosage du HDL-cholestérol
- Principe du test :Les LDL sont
précipités par addition de l'acide phosphotungstique en
présence des ions magnésium. La fraction HDL reste dans le
surnageant et est déterminée par le dosage du
cholestérol.
- Réactifs :
|
Précipitant :
|
Acide phosphotungstique
|
0,55 mmol/l
|
|
Chlorure de Magnésium
|
25 mmol/l
|
|
Standard :
|
Cholestérol
|
1,29 mmol/l (50 mg/dl)
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit :
|
|
Macro
|
Semi Micro
|
|
Échantillon
|
500 ul
|
200 ul
|
|
Précipitant HDL
|
1000 ul
|
-
|
|
Précipitant dilué
|
-
|
500 ul
|
|
Les préparations ont été
homogénéisées puis incubées pendant 10 minutes
à température ambiante. Elles ont ensuite été
centrifugées à 4000 trs/mn. Le contenu en cholestérol a
été déterminé dans le surnageant clair dans les 2
heures qui suivaient, par la méthode CHOD-PAP.
|
|
PROCEDURE DU CHOD-PAP CHOLESTEROL : Un seul
réactif blanc a été utilisé par série. Le
Pipetage s'est fait dans les tubes d'essai comme suit :
|
|
Réactif blanc
|
Standard
|
échantillon
|
|
Eau distillée
|
100 ul
|
-
|
-
|
|
Surnageant
|
-
|
-
|
100 ul
|
|
Standard
|
-
|
100 ul
|
-
|
|
Réactif
|
1 ml
|
1 ml
|
1 ml
|
|
Les préparations ont été
homogénéisées puis incubées 10 minutes à
température ambiante. Puis l'absorbance du standard et des
échantillons a été lue contre celle du réactif
blanc dans l'heure.
|
- Calcul de la concentration de HDL :
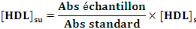
- [HDL]su : Concentration de HDL dans le
surnageant
- [HDL]s : Concentration de HDL dans le
standard
- Abs : mesure de l'absorbance
Ø Dosage des triglycérides
- Principe du test :Les triglycérides sont
hydrolysés par la lipoprotéine lipase pour donner le
glycérol et des acides gras. Puis, par l'action successive de la
glycérol kinase en présence de Mg2+ et de la
glycérol phosphatase en présence d'ATP, le glycérol est
convertit en dihydroxyacétone phosphate et peroxyde d'hydrogène.
Le peroxyde d'hydrogène à son tour réagit avec le
chlorophénol et le 4-amino-antipyrine en présence de la
peroxydase pour produire le 4-(p-benzoquinone-monoimino)-phenazone
coloré. L'intensité de la coloration produite est directement
proportionnelle à la concentration de triglycérides dans
l'échantillon.
- Réactifs
|
Tampon :
|
Tampon pH 7.8
|
50 mmol/l
|
|
p-chlorophénol
|
2 mmol/l
|
|
Lipoprotéine Lipase
|
150000 U/l
|
|
Glycérolkinase
|
800 U/l
|
|
Glycérol-3-P-oxydase
|
4000 U/l
|
|
Peroxydase
|
440 U/l
|
|
4-aminoantipyrine
|
0,7 mmol/l
|
|
ATP
|
0,3 mmol/l
|
|
Mg2+
|
40 mmol/l
|
|
Na-cholate
|
0,20 mmol/l
|
|
Potassium-Hexacyanoferrate(II)
|
1 umol/l
|
|
Standard :
|
Concentration de triglycérides de 200 mg/dl
|
2,24 mmol/l
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit :
|
|
Réactif blanc
|
Standard/échantillon
|
|
Eau distillée
|
10 ul
|
-
|
|
Standard/Echantillon
|
-
|
10 ul
|
|
Réactif
|
1000 ul
|
1000 ul
|
|
Les préparations ont été
homogénéisées puis incubées pendant 10 minutes
à 20-25°C. Puis l'absorbance des standard et échantillons a
été lue contre celle du réactif blanc.
|
- Calcul de la concentration de
triglycérides
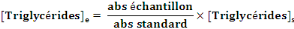
- [triglycérides]e : Concentration de
cholestérol dans l'échantillon
- [triglycérides]s : Concentration de
cholestérol dans le standard
- abs : mesure de l'absorbance
Ø Dosage de la créatinine
- Principe du test :La créatinine
réagit avec l'acide picrique en milieu alcalin pour former un complexe
jaune intense. La quantité de complexe formé est directement
proportionnelle au taux de créatine dans l'échantillon.
- Réactifs
|
Hydroxyde de sodium :
|
0,32 mol/l
|
|
Acide picrique :
|
35 mmol/l
|
|
Standard :
|
177 umol/l (2 mg/dl)
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit :
|
|
Standard/échantillon
|
|
Standard/échantillon
|
100 ul
|
|
Réactif de travail
|
1 ml
|
|
Les préparations ont été
homogénéisées. Puis l'absorbance des standard et
échantillons a été lue après 30 secondes puis
encore après exactement 120 secondes.
|
- Calcul de la concentration de
créatinine
Le changement dans l'absorbance de
l'échantillon/standard (Äabs) = abs. à 150 secondes - abs.
à 30 secondes.
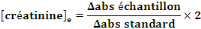
- [créatinine]e : Concentration de
cholestérol dans l'échantillon (mg/dl)
- abs : mesure de l'absorbance
Ø Dosage de la bilirubine totale
- Principe du test :La bilirubine totale
réagit avec le 2,4-dichloroaniline pour former l'azobilirubine. La
bilirubine liée à l'albumine est libérée par un
détergent.
- Réactifs
|
Réactif DCA :
|
Détergent
|
58 g/l
|
|
HCl
|
80 mmol/l
|
|
2,4-dichloroaniline
|
3.0 mmol/l
|
|
Nitrite de sodium :
|
|
2.5 mmol/l
|
|
Réactif blanc :
|
Détergent
|
29 g/l
|
|
HCl
|
40 mmol/l
|
|
2,4-dichloroaniline
|
1.5 mmol/l
|
- Réactif de travail :
Le réactif DCA (dichloroaniline) est
mélangé à égal volume avec le réactif
nitrite.
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit :
|
|
échantillon
|
échantillon blanc
|
|
échantillon
|
100 ul
|
100 ul
|
|
Réactif de travail
|
1000 ul
|
-
|
|
Réactif à blanc
|
-
|
1000 ul
|
|
Les préparations ont été
homogénéisées et laissées pendant 10 minutes
à température ambiante, à l'abri de la lumière.
Puis l'absorbance des échantillons a été lue contre celle
de l'échantillon blanc dans les 60 minutes.
|
- Calcul de la bilirubine totale
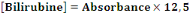
- [Bilirubine] : concentration de bilirubine (mg/dl)
Ø Dosage des protéines
totales
La méthode du Biuret décrite par Gornall et
al., (1949) a été utilisée pour doser les
protéines sériques.
- Principe : En milieu basique, le tartrate forme
avec le sel cuivrique un complexe soluble. L'addition d'une protéine
déplace le cuivre complexé pour former un autre complexe
cuivro-protéique de couleur violette. L'intensité de coloration
est proportionnelle à la concentration des protéines dans la
solution à doser.
- Protocole de dosage
Les tubes utilisés pour le dosage des protéines
ont été préparés et complétés avec
les différents réactifs suivant l'ordre présenté
dans le tableau IIIci-après.
Tableau III: protocole de dosage des
protéines
|
N° tube
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
X1
|
...
|
Xn
|
|
SAB (5 mg/mL)
|
0
|
0,25
|
0,5
|
0,75
|
1
|
1,25
|
1,75
|
0
|
...
|
0
|
|
Eau distillée (mL)
|
3
|
2,75
|
2,5
|
2,25
|
2
|
1,75
|
1,25
|
2,95
|
...
|
2,95
|
|
Réactif de Biuret (mL)
|
2
|
2
|
2
|
2
|
2
|
2
|
2
|
2
|
...
|
2
|
|
Sérum (uL)
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
50
|
...
|
50
|
|
Quantité de protéines (mg)
|
0
|
1,25
|
2,5
|
3,75
|
5
|
6,25
|
7,5
|
?
|
...
|
?
|
Tube 0 : tube blanc ; Tube 1 à 5 : tubes
étalons ; Tubes X1 à Xn : tubes échantillons
Dans une série des tubes à essai a
été introduit successivement 50 uL de sérum puis 2 ml de
la solution de Biuret. L'ensemble a été
homogénéisé par le vortex et incubé pendant 20
minutes à température ambiante. Dans le tube témoin, le
sérum a été remplacé par l'eau distillée.
L'absorbance est lue à 540 nm à l'aide d'un
spectrophotomètre (type Genesis) contre le témoin. La
concentration des protéines dans les différents tubes
échantillons a été déterminée à
partir de la courbe d'étalonnage réalisé avec une solution
de SAB (Figure 6).
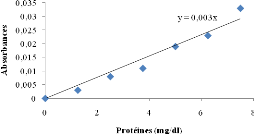
Figure 6 : Courbe d'étalonnage du
dosage des protéines par la méthode de Biuret
Ø Dosage de l'ALAT
- Principe du test :Le dosage repose sur le
transfert enzymatique médié parL'ALAT d'un groupement amine de la
L-alanine au á-oxoglutarate pour obtenir le L-glutamate et le
pyruvate.
- Réactifs
|
Tampon :
|
Tampon phosphate
|
100 mmol/l
|
|
L-alanine
|
200 mmol/l
|
|
á-oxoglutarate
|
2,0 mmol/l
|
|
Réactif coloré :
|
2,4-dinitrophenyl hydrazine
|
2,0 mmol/l
|
|
Standard pyruvate :
|
Pyruvate
|
2,0 mmol/l
|
|
Hydroxyde de sodium :
|
|
4,0 mol/l
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit (37°C):
|
|
Réactif blanc
|
Test
|
|
Echantillon
|
-
|
100 ul
|
|
Tampon ALAT (R1)
|
500 ul
|
500 ul
|
|
Eau distillée
|
100 ul
|
-
|
|
Les préparations ont été
homogénéisées et incubées pendant exactement 30
minutes à 37°C dans un bain-marie.
|
|
Réactif coloré ALAT (R2)
|
500 ul
|
500 ul
|
|
Les préparations ont été
homogénéiséeset incubées pendant exactement 20
minutes à température ambiante.
|
|
NaOH (dilué)
|
5,0 ml
|
5,0 ml
|
|
Les solutions ont été
homogénéiséespuis l'absorbance a été lue
contre le réactif blanc après 5 minutes. L'activité de
l'ALAT correspondante à la densité optique lue s'est faite via la
courbe d'étalonnage de (Figure 7).
|
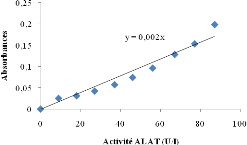
Figure 7 : Courbe
d'étalonnage de l'activité ALAT
Ø Dosage de l'ASAT
- Principe du test :Le dosage repose sur le
transfert enzymatique médié par l'ASATd'un groupement amine de la
L-aspartate au á-oxoglutarate pour obtenir le L-glutamate et
l'oxaloacétate.
- Réactifs
|
Tampon :
|
Tampon phosphate
|
100 mmol/l
|
|
L-aspartate
|
200 mmol/l
|
|
á-oxoglutarate
|
2,0 mmol/l
|
|
Réactif coloré :
|
2,4-dinitrophenyl hydrazine
|
2,0 mmol/l
|
|
Standard pyruvate :
|
Pyruvate
|
2,0 mmol/l
|
|
Hydroxyde de sodium :
|
|
4,0 mol/l
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit (37°C):
|
|
Réactif blanc
|
Test
|
|
Echantillon
|
-
|
100 ul
|
|
Tampon ASAT (R1)
|
500 ul
|
500 ul
|
|
Eau distillée
|
100 ul
|
-
|
|
Les préparations ont été
homogénéiséeset incubées pendant exactement 30
minutes à 37°C dans un bain-marie.
|
|
Réactif coloré ASAT (R2)
|
500 ul
|
500 ul
|
|
Les préparations ont été
homogénéisées et incubées pendant 20 minutes
à température ambiante.
|
|
NaOH (dilué)
|
5,0 ml
|
5,0 ml
|
|
Les solutions ont été
homogénéisées puis l'absorbance a été lu
contre le réactif blanc après 5 minutes. L'activité de
l'ASAT correspondante à la densité optique lue s'est faite via la
courbe d'étalonnage (Figure 8).
|
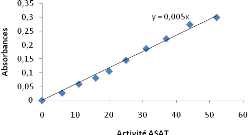
Figure 8: Courbe d'étalonnage de
l'activité ASAT
| 


