3.1.4. Propriété
physico-chimique du sel
Le chlorure de sodium (NaCl), composé ionique, se
présente sous forme d'un réseau cristallin d'ions chlore
(Cl-) et sodium (Na+) régulièrement
disposés dans l'espace les uns par rapport aux autres. Testaniere
(2001), dans son cours de Chimie - Classe de première - Série
S le schématise comme un cube à face centrée tel
qu'indiqué sur la figure 4 ci-dessous.
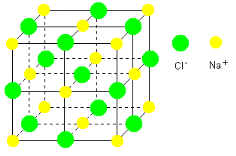
Figure 4 : La
structure d'un cristal de chlorure de sodium.
3.3.4.1- La
solubilité du Chlorure de sodium
Lorsqu'on met du sel (chlorure de sodium) dans l'eau, celui-ci
se dissout. La dissolution est une conséquence du caractère
dipolaire de l'eau (Encyclopædia Universalis, 2007). Les molécules
d'eau polaires s'orientent sous l'action de forces électriques. Leur
pôle négatif (atome oxygène ·O·) est
attiré par un ion Na+, leur pôle positif (situé
au milieu des atomes hydrogène ·H·) est attiré par
un ion Cl- (Testanière, 2001). L'eau entoure et sépare
ainsi progressivement chacun des ions (voir figure 5).
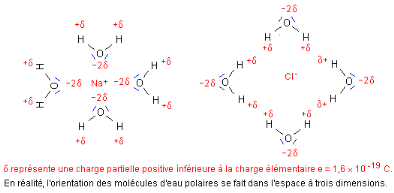
Figure 5 :
Comportement du sel dans l'eau
L'équation de la réaction qui se produit
lorsqu'on dissout le chlorure de sodium solide dans l'eau s'écrit :
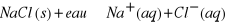 . Retenons que dans cette écriture, (s) est mis pour
solide et (aq) pour aqueux. . Retenons que dans cette écriture, (s) est mis pour
solide et (aq) pour aqueux.
3.3.4.2- La
conductibilité électrique
La conductibilité électrique d'une solution
résulte de la présence et de la mobilité des ions à
l'intérieur de la solution. Elle dépend de la nature et de la
concentration des ions, ainsi que de la température. Karapétiantz
(1978) soutient que, la conductivité décroît avec la
dilution de la solution. Il l'explique selon au fait que, la dilution diminue
la proportion d'électrolytes dans la solution. La mesure de la
conductivité électrique d'une solution (conductimétrie)
permet donc d'estimer sa teneur globale en ions, et se révèle
être aussi un bon outil d'étude du comportement des solutés
dans les solutions.
La solution aqueuse de NaCl conduit le courant
électrique car le NaCl se dissout bien dans l'eau en cations
Na+ et anions Cl- : Soumillion et Ghins (2002)
parlent de dissociation électrolytique en solution (les ions se
séparent). Chemical education material study (1965) nous enseigne que la
dissolution du sel favorise peut-être la production de particules
chargées électriquement et que, le déplacement de ces
particules chargées dans la solution permet la circulation du
courant.
| 


