CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
fabrication simples avec une grande stabilité
vis-à-vis la température, les détergents et les enzymes
protéolytiques (K.E. Jaeger et al.,1994).
? Origine bactérienne
Les bactéries répondues dans la production de
lipases sont plusieurs, et vu que la classification des microorganismes peut
changer à l'issue de nouvelles découvertes taxonomique ; le nom
des lipases microbiennes souvent été modifié à
titre d'exemple la lipase de Pseudomonas fluorescens est devenue
lipase de Pseudomonas cepaci ; la lipase de Candida cylindracea
est devenue lipase de Candida rugosa (A. Najjar,2010).
La lipase de Serratia marcescens est utilisée pour la
production de Méthyl-glycidate, employée dans la synthèse
d'un antagoniste du calcium (A.Rihani,2012).
? Origine fongique
La lipase de Yarrowia lipolytica est en cours de
développement au centre wallon de biologie industrielle et son
application qui intéresse le secteur clinique (W.A.M.Alloue et
al., 2008). La lipase de Mucor javanicus,
utilisée dans l'extraction et le fractionnement des huiles marines
extraites à partir des poissons et des algues, conduit à une
diversité de molécule d'acylglycéroles et trouvent de
nombreuses applications dans le domaine agroalimentaire et de la santé
(M.Linder et al.,2004).
1.2.3. Propriétés physico-chimiques des
lipases
Des études quantitatives sur la production de lipase et
les facteurs modifiant la libération
de l'enzyme dans le milieu de croissance, ont
été décrites chez de nombreux microorganismes
(tableau 3).
Tableau 3 : caractéristiques
physico-chimiques des microorganisme producteurs des lipases
|
Source
|
pH
|
Température(C O)
|
Références
|
|
Staphylococcus hominis MTCC 898
|
7,9
|
33,1
|
(AL. Behera et al., 2019)
|
|
Pseudomonas reinekei
|
5,0-9,0
|
40
|
(P. Priyanka et al., 2019)
|
|
Amycolatopsis sp AS9
|
7-24
|
30
|
(R. Balachandar et al., 2019)
|
|
Streptomyces griseochromogenes LE-11
|
7,0
|
55
|
(B. Gunalakshmi et al., 2008)
|
|
|
Aspergillusniger MTCC
|
6
|
40
|
(N. Ashutosh et al., 2019)
|
14
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
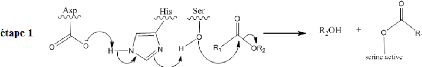
1.2.4. Mécanisme d'action des lipases
Les lipases diffèrent entre elles par le nombre
d'acides aminés constituant leur structure primaire. Par exemple, la
lipase de Candida rugosa contient plus de 500 acides aminés
tandis que la lipase de Candida antarctica B en contient 317.
Cependant, la caractéristique commune de toutes les lipases est que
leurs sites actifs sont constitués de trois acides aminés,
appelés la triade : sérine, aspartate ou glutamate et histidine
(A.Ghanem,2007).
Cette triade d'acides aminés, ajoutée à
quelques autres résidus, constitue le site actif de l'enzyme. Celui-ci
est protégé par un « couvercle » qui en bloque
l'accès et ne s'ouvre qu'au contact d'une phase hydrophobe pour
permettre la complexation du substrat, lipide hydrophobe, et faciliter ainsi la
catalyse de la réaction. Cette activation interfaciale du biocatalyseur
constitue la caractéristique principale des lipases. Le mécanisme
d'intervention de la triade (Ser, Hist et Asp) lors de l'hydrolyse d'un ester
est donné par le schéma suivant (R.D. Schmid et
al.,1998):
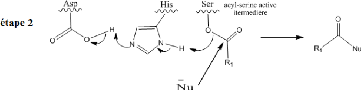
Figure 4 : Mécanisme d'intervention de
la triade (Ser-Hist-Asp) et formation de l'acyl-
enzyme.
Comme le montre le schéma ci-dessus, la disposition
particulière des trois résidus formant
la triade permet, dans une première étape,
l'attaque nucléophile du substrat R1CO2R2 pour donner un complexe
appelé acyl-enzyme avec libération de l'alcool R2OH.
Dans une seconde étape, cet intermédiaire
acyl-enzyme subit une attaque nucléophile par
l'eau présente dans le milieu,
régénérant ainsi l'enzyme par expulsion de l'acide R1CO2H,
produit de la réaction.
15
| 


