3) Production de la protéine mature PRO564
Le vecteur d'expression pQE-31 encodant la protéine PRO564
a été obtenu à partir du plasmide pQE-31 contenant le
gène PRODH par délétion. Après
vérification de sa séquence,
ce nouveau vecteur a été intégré dans
des souches BL21 thermocompétentes préalablement
transformées par le plasmide pREP-4.
Les protocoles d'expression et d'extraction que nous
avons appliqués pour tester la solubilité de la nouvelle
construction sont tout à fait identiques à ceux utilisés
pour produire PRODH sauvage. Les cultures d'expression de 30 mL de PRO564 ont
été induites à une DO mesurée à 600 nm de
0.5 par ajout de 1 mM d'IPTG, puis incubées à 37°C pendant 3
heures. Après lyse des bactéries, les protéines
cytosolubles ont été extraites par centrifugation, et le
matériel insoluble a été repris avec de l'urée 8 M.
Après une seconde étape de centrifugation,
les agrégats du culot final ont été
solubilisés avec du SDS.
A l'instar de PRODH sauvage, nous avons
également réalisé une optimisation de plusieurs
paramètres comme la quantité d'inducteur IPTG (0.1 mM, 0.5
mM, et 1 mM), la température d'expression (29°C et 37°C), et
la nature du détergent utilisé dans le tampon de lyse (Triton
X-100, NP 40, et Tween 20). Les meilleurs taux d'expression pour l'ensemble des
fractions ont été obtenus avec une concentration d'IPTG de 0.1
mM, une température de
29°C, et en utilisant du Triton X-100 à 2 %.
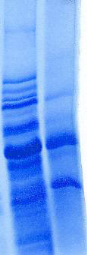
L'analyse SDS-PAGE de l'expression de
PRO564 dans ces conditions est présentée dans la
Figure 2.3.
Comme le montre la Figure 2.3, une bande de surexpression dont
la masse apparente correspond à la masse attendue (66 kDa) est
observable dans les fractions contenant le culot final et les
protéines insolubles reprises dans l'urée. Toutefois, cette
bande d'expression n'apparaît pas dans le surnageant de lyse contenant
les protéines solubles. D'autre part, nous avons constaté que
l'optimisation des conditions expérimentales citées
ci-dessus n'a eu aucune influence sur la solubilité de la
protéine recombinante. Par conséquent, à l'image de la
protéine hétérologue PRODH sauvage, la surexpression
de PRO564 chez E. coli conduit à l'unique formation
de corps d'inclusion. Nous avons toutefois noté une
différence significative entre le profil d'expression de la forme
mature et celui de la forme sauvage. Lorsque nous avons produit PRODH
humaine, la reprise du matériel insoluble par de l'urée
8 M pendant 6 heures n'a pas été suffisante
pour dénaturer ne serait-ce qu'une partie de
protéine insoluble PRODH. Dans le cas de PRO564, plus d'un
tiers de protéine insoluble a été dénaturée
par l'urée dans les mêmes conditions. Par conséquent, ceci
laisse supposer la part
de responsabilité du peptide signal dans
l'agrégation de PRODH recombinante.


SN U C
(kDa)
91
PRO564
50
Figure 2.3 : Expression de la
protéine PRO564 chez E. coli. Analyse SDS-PAGE des
fractions contenant, les protéines solubles (SN), les
protéines insolubles resolubilisées dans l'urée 8 M (U),
et le culot final repris dans du SDS (C).
| 


