CHAPITRE 3
Stratégie d'étude par RMN et
Modélisation
Moléculaire du domaine K2
La radiocristallographie et la Résonance Magnétique
Nucléaire sont à ce jour les deux
techniques qui permettent d'obtenir la structure 3D
d'une protéine à l'échelle atomique. Comparée
à la RMN, les avantages principaux de la radiocristallographie sont
d'une part, la précision de l'information obtenue et d'autre part,
l'accès à des masses moléculaires élevées
(> 200 kDa). Il en découle que la grande
majorité des structures publiées sont résolues par cette
technique moins restreinte, et souvent moins coûteuse en terme de temps
d'interprétation des données. La spectroscopie de RMN n'est
donc, à priori, pas la méthode de choix pour
déterminer la structure tridimensionnelle d'une protéine.
Cependant, elle est le seul recours lorsque l'obtention d'un
monocristal ou la détermination des phases est impossible. Sa
principale qualité se situe dans l'étude des dynamiques
moléculaires et d'interactions entre les molécules, étape
clef de l'exploration des relations structure activité. Ces
quinze dernières années ont fait l'objet d'importants
développements techniques et méthodologiques qui rendent
la spectroscopie de RMN plus efficace dans la résolution
de structures macromoléculaires. Ces progrès ont notamment
visé à améliorer la résolution et la
sensibilité de la technique.
La fréquence de résonance du proton, qui traduit
l'intensité des aimants supraconducteurs, peut atteindre à
présent jusqu'à 950 MHz. L'augmentation de résolution
qui
en découle a été accompagnée par
l'apparition de sondes de mesure, à une température proche
de celle de l'hélium liquide (cryosondes), qui offrent un
gain de sensibilité d'un facteur 2 à 4
comparée aux sondes classiques. Ces grandes
avancées technologiques n'auraient cependant
pas été suffisantes sans le développement,
de séquences RMN 3D et 4D (Marion et al., 1989 ; Clore & Gronenborn,
1991), et de méthodes de marquage(s) isotopique(s) des noyaux
15N, 13C,
et 2D (Redfield et al., 1989 ; Xu et
al., 1999), qui permettent l'étude structurale de
biomolécules de taille de plus en plus importante.
Parmi ces progrès méthodologiques, figure notamment la
spectroscopie TROSY (Transverse Relaxation Optimized spectroscopY)
(Pervushin et al., 1997) utilisée à hauts champs pour
des protéines de masse supérieure à
20 kDa, et dont la combinaison à un marquage au
deutérium 2D, apporte un gain considérable
en résolution et en sensibilité. En amont du calcul
de la structure, l'émergence de programmes d'attribution automatique ou
semi-automatique, des résonances (Zimmerman et al., 1997), ou
des pics nOe (Nilges et al., 1997), rend la collecte
des contraintes structurales RMN moins lourde, et donc moins coûteuse
en temps. L'application de l'ensemble de ces développements permet
aujourd'hui de trouver dans la littérature des reports d'attribution de
protéines de plus
de 80 kDa (Tugarinov et al., 2004), ainsi que des structures
tridimensionnelles de protéine de
48 kDa résolues par RMN (Williams et al., 2005). Cela
étant, pour des protéines de cette taille,
les moyens employés en termes de production
d'échantillons (nécessité de différents
marquages spécifiques et onéreux), temps
d'enregistrement des expériences, et temps
d'interprétation des données, deviennent alors
considérables.
Stratégie générale de l'étude
structurale de K2 par RMN et Modélisation Moléculaire
La stratégie adoptée pour caractériser la
structure d'une protéine par spectroscopie de
RMN et Modélisation Moléculaire
dépend de sa masse moléculaire, ainsi que des outils
d'analyse et de traitement à disposition du structuraliste. Le
domaine K2 de KIN17 est une protéine de 111 acides aminés,
que l'on peut qualifier de taille moyenne pour une étude par RMN. Les
différentes étapes de la méthodologie employée pour
résoudre la structure de K2 sont schématisées en Figure
3.1, et sont détaillées dans ce chapitre.
Préparation des échantillons
de protéine marquée 15N,
et
15N /
13C
Attribution des raies de résonance de la
protéine
Détermination de la topologie
- chaîne principale
- chaînes latérales
- déplacements chimiques
- nOe 1H-1H caractéristiques des
structures secondaires
- constantes de couplage 3JHN-Há
- nOe hétéronucléaire
1H-15N
- vitesses d'échange 1H-2D
Calcul de la structure par
Modélisation
Moléculaire sous contraintes RMN

- attribution automatique des nOe
- dynamique moléculaire sous CNS
Recueil des contraintes structurales
- nOe 1H-1H
- angles dièdres et
- liaisons hydrogène
Structure 3D
Figure 3.1 : Résumé
des principales étapes de la stratégie d'étude structurale
du domaine K2
1) Méthode d'attribution des raies de
résonance
Après avoir préparé un échantillon
de protéine pur, concentré, et stable, l'enregistrement des
expériences RMN peut débuter. Les informations et contraintes
structurales ne peuvent être directement extraites des spectres RMN. Il
est tout d'abord nécessaire de déterminer les déplacements
chimiques de chacun des atomes de la biomolécule. Le choix de la
stratégie à employer pour attribuer les raies de
résonance est dicté par la taille de la protéine
étudiée. Pour une protéine de 111 résidus
comme le domaine K2, l'attribution peut être menée par
deux méthodes distinctes qui dépendent du type de
marquage isotopique de l'échantillon.
La première de celles-ci est basée sur
l'enregistrement d'expériences 3D hétéronucléaires
de type 15N-TOCSY-HSQC et 15N-NOESY-HSQC.
L'attribution des résonances 1H et 15N est alors
réalisée selon la stratégie décrite dans l'ouvrage
de Wüthrich (Wüthrich, 1986) qui repose sur les couplages
homonucléaires scalaire et dipolaire 1H-1H.
Cette méthode est généralement applicable à
des protéines contenant jusqu'à 130 acides aminés, et
présente l'avantage de ne nécessiter qu'un simple marquage
15N. Toutefois, pour
des polypeptides de cette taille, qui adoptent une structure
tertiaire, ce type de stratégie basée
sur l'identification du nOe présente un
caractère ambigu. De plus, dès 100 résidus,
l'augmentation de la taille peut conduire à une réduction de
l'efficacité du transfert TOCSY
1H-1H, qui engendre une diminution du
nombre de résonances, et notamment dans les régions
structurées en hélice où les
constantes de couplage 3JHN-Há sont faibles. C'est le
cas de la protéine K2 où la quantité d'information
recueillie sur le spectre 15N-TOCSY-HSQC est insuffisante pour
envisager l'attribution complète des fréquences 1H et
15N par cette stratégie.
Il existe pour les protéines doublement marquées
15N / 13C une attribution séquentielle alternative
basée uniquement sur des transferts de cohérence via
les couplages scalaires homonucléaires et
hétéronucléaires. La méthode repose sur
l'enregistrement d'une combinaison d'expériences 3D
hétéronucléaires de double ou triple résonance
qui corrèlent chacune 2 ou 3 types de noyaux différents. Cette
stratégie, utilisée pour attribuer l'ensemble des
résonances de la chaîne principale de la protéine
K2, est présentée dans le paragraphe
suivant.
1.1) Attribution des carbones de la chaîne
principale et des 13Câ
1.1.1) Stratégie
générale
Les expériences 3D de triple résonance
utilisées classiquement pour l'attribution du squelette d'une
protéine doublement marquée sont, pour la plupart d'entre elles,
basées sur le même principe : la corrélation du proton
amide d'un résidu i avec respectivement, l'azote qui
le porte, et un carbone Ci (CO, Cá, ou Câ)
du résidu précédent et/ou du même
résidu. Ces corrélations, dépendant du chemin de
cohérence sélectionné, se font par le transfert
successif
de l'aimantation à travers plusieurs liaisons
covalentes via des couplages scalaires 1,2J
relativement élevés (1JC-C,
1JC-N, 1JH-N, 1JH-C, 2JC-N,
et 2JC-C). Les six expériences 3D couramment
utilisées pour l'attribution complète des noyaux
1HN, 15N, 13CO, 13Cá, et
13Câ sont : HNCA, HN(CO)CA, HNCO, HN(CA)CO, CBCANH, et
CBCA(CO)NH (Pour revues : Cavanagh et al., 1996 ; Sattler et al., 1999 ;
Kanelis et al., 2001). Le nom de ces expériences indique les noyaux qui
sont impliqués dans les chemins de cohérence suivis. Les noyaux
mis entre parenthèses ne sont pas édités en
fréquence et servent uniquement à relayer
l'aimantation. On peut classer ces six expériences en deux
catégories distinctes :
- La première corrèle le groupement amide du
résidu i avec les carbones 13C du résidu i-1,
et permet ainsi d'obtenir les déplacements chimiques du
triplet (Ni ; HN ; C ).
i i-1
- Dans la seconde catégorie, le groupement amide du
résidu i est relié aux carbones 13C
du résidu i et du résidu i-1. L'information obtenue
est alors double, et les déplacements
chimiques recueillis constituent le quadruplet (Ni ; HN ; C
; C ).
i i-1 i
La combinaison de ces deux types d'expériences peut donc
permettre de déterminer
sans ambiguïté les déplacements chimiques des
carbones 13CO, 13Cá, et 13Câ des
résidus i et
i-1 relatifs à chaque groupement amide. Il est alors
possible de connecter les résidus deux à deux en comparant les
valeurs de déplacements chimiques Ci des uns aux valeurs de Ci-1 des
autres (Figure 3.2). Finalement, le rapprochement de cette attribution
séquentielle à la séquence primaire est initié en
recherchant les acides aminés particuliers qui présentent des
valeurs de déplacement chimique caractéristiques. C'est le cas de
la glycine qui ne possède
pas de Câ, et des résidus thréonine,
sérine et alanine, dont les valeurs de déplacement
chimique de Cá et Câ sont spécifiques.
Liste de déplacements chimiques (Ni ;
HNi ; Ci-1 ; Ci)
C C
N C C N C
C
C C
N C C N C C
C C
N C C N C C
H H O H H O
H H O H H O
H H O H H O
|
C
|
|
|
C
|
|
|
C
|
|
|
C
|
|
|
C
|
|
|
C
|
|
|
N
|
C
|
C
|
N
|
C
|
C
|
N
|
C
|
C
|
N
|
C
|
C
|
N
|
C
|
C
|
N
|
C
|
C
|
|
H
|
H
|
O
|
H
|
H
|
O
|
H
|
H
|
O
|
H
|
H
|
O
|
H
|
H
|
O
|
H
|
H
|
O
|
C C C
C C C
N C C N
C C N
C C N
C C N
C C N C C

H H O H
H O H
|
i
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i+6
|
|
C
|
|
|
C
|
|
|
C
|
|
|
C
|
|
|
C
|
|
|
C
|
|
|
|
N
|
C
|
C
|
N
|
C
|
C
|
N
|
C
|
C
|
N
|
C
|
C
|
N
|
C
|
C
|
N
|
C
|
C
|
|
|
H
|
H
|
O
|
H
|
H
|
O
|
H
|
H
|
O
|
H
|
H
|
O
|
H
|
H
|
O
|
H
|
H
|
O
|
|
H O H
H O H
H O H H O
Figure 3.2 : Principe de
l'attribution séquentielle basée sur l'enregistrement
d'expériences 3D
i
de triple résonance 1H, 15N,
13C. Chaque groupement amide (HNi ; NH ) est
associé aux triplets
de déplacements chimiques (13COi ; 13Cái
; 13Câ ) et (13CO
; 13Cá
; 13Câ
) relatifs aux
i i-1
i-1
i-1
résidus i, et i-1. Les connexions de la
séquence peptidique sont retracées résidu par
résidu en comparant les valeurs de déplacements chimiques
13Ci aux valeurs de 13Ci-1 triplet par triplet.
Les valeurs de déplacement chimique des
noyaux 13CO, 13Cá, et
13Câ sont respectivement déterminées, par les
couples d'expériences HNCO et HN(CA)CO, HNCA et HN(CO)CA, CBCANH et
CBCA(CO)NH. Ces expériences s'interprètent par paire et chaque
couple fournit un chemin d'attribution potentiel.
1.1.2) Description des expériences 3D triple
résonance
Les séquences d'impulsion des expériences
3D de triple résonance utilisées pour l'attribution
séquentielle sont toutes du même type : la séquence
débute par un transfert de polarisation de type INEPT (Insensitive
Nuclei Enhanced by Polarisation Transfert) du proton
1H vers l'hétéroatome (15N ou
13C) qui le porte (Figure 3.3). L'aimantation évolue ensuite
en
fonction de différents couplages scalaires et du
déplacement chimique 13Ci avant d'être
transférée vers le noyau amide 15NH via le
couplage 15N-13Cá ou
15N-13CO. Finalement, un
transfert de polarisation de type INEPT-inverse permet de
détecter l'aimantation sur le noyau
amide 1HN.
J
1
C-H
(130 Hz)
J
1
X-H,
13CO
13Cá
1
1JN-CO
2
1JN-H (90 Hz)
2JX-H, ...
13Câ
JN-Cá ,
JN-Cá
1JN-H (90 Hz)
1HN/á/â
INEPT
15NH 13
C
13 Ci
á/â
15NH
INEPT-inverse
1HN
(t1) (t2) (t3)
Figure 3.3 : Représentation
schématique du transfert de l'aimantation dans une
expérience
3D triple résonance de type HNCA,
HN(CO)CA, HNCO, HN(CA)CO, CBCANH, ou
CBCA(CO)NH.
a) Attribution des Cá
L'expérience HNCA corrèle le groupement amide
au carbone Cá via le couplage scalaire
15N-13Cá. Sur les spectres correspondants, deux
pics peuvent apparaître par résidu :
une première corrélation du groupement amide
avec le Cái, et une seconde avec le
Cái-1
(Figure 3.4). Ceci s'explique par les valeurs de constante de
couplage 1JN-Cá (11 Hz) et 2JN-Cá
(-7 Hz) qui sont du même ordre de grandeur. La
différence d'intensité des deux pics, due au
fait que |1JN-Cá| >
|2JN-Cá|, pourrait permettre de distinguer le
déplacement chimique provenant
du Cái, de celui du Cái-1.
Il est cependant préférable de vérifier une telle
attribution à l'aide de l'expérience HN(CO)CA
complémentaire. Celle-ci corrèle le groupement amide au
seul carbone Cá-1 en deux étapes via le carbonyle
13COi-1 non édité. La différence de constante
de couplage 1JN-CO (15 Hz) et 2JN-CO (1 Hz) permet
d'orienter sélectivement l'aimantation vers le
13COi-1, puis vers le Cái-1 via la
liaison 1JCO-Cá (55 Hz).
Ces deux expériences fournissent un premier
chemin d'attribution séquentielle et pourraient suffire à
connecter tous les résidus deux à deux. Cependant, pour la
majorité des acides aminés, les déplacements
chimiques de Cá ne sont pas caractéristiques, et ne
permettent une attribution sans ambiguïtés. De plus, le
recouvrement des pics de corrélation dans les régions
encombrées des spectres peut induire une incertitude sur certaines
valeurs de
déplacement chimique de Cá.
HN(CO)CA
HNCA
|
|
H
|
O
|
H
|
H
|
O
|
|
H
|
O
|
H
|
H
|
O
|
|
A)
|
|
C
|
C
|
N
|
C
|
C
|
|
C
|
C
|
N
|
C
|
C
|
|
H
|
C
|
H
|
H
|
C
|
H
|
H
|
C
|
H
|
H
|
C
|
H
|
13Cá
B)
CáX-1
CáY-1
15N
13Cá
CáY
CáX
CáY-1
CáX-1
15N
HX HY
NY
NX
1HN
HX HY
NY
NX
1HN
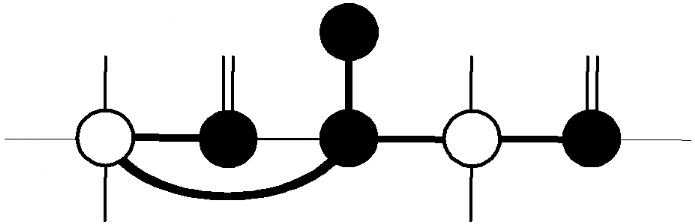
Figure 3.4 : Expériences 3D
de triple résonance utilisées pour l'attribution des
13Cá d'une protéine. A) Schéma du transfert de
l'aimantation dans les expériences HN(CO)CA et HNCA.
Les noyaux édités en fréquence
sont indiqués par des cercles noirs, alors que ceux uniquement
relayés, sont indiqués par des cercles blancs. B) Exemple
illustré de spectres HN(CO)CA et HNCA correspondants à un
segment de 2 résidus consécutifs X-Y ; mise en
évidence de la connectivité séquentielle.
b) Attribution des CO
Selon le même principe, les expériences
HNCO et HN(CA)CO procurent les corrélations entre les
résonances 1HN et 15NH et les 13CO
intra- et inter-résidus (Figure 3.5). L'expérience HNCO fournit
uniquement une corrélation avec le carbonyle 13COi-1
via la constante de couplage 1JN-CO. La HN(CA)CO utilise
les couplages scalaires 1JN-Cá, 2JN-Cá,
et
1JN-CO pour relier le 13COi et le
13COi-1 au groupement amide via le noyau (CA) non
édité. A
l'instar de l'expérience HNCA, l'intensité du pic
inter-résidu est généralement plus faible que celle du pic
intra-résidu du fait que |1JN-Cá| >
|2JN-Cá|.
Alors que la HNCO est l'expérience de
triple résonance la plus sensible, la HN(CA)CO est la moins
sensible. Toutefois, il existe d'autres expériences, comme la
(HCA)CO(CAN)NH, qui permettent d'obtenir les corrélations des
13CO intra- et inter-résidus,
et qui sont plus sensibles que la HN(CA)CO. Cependant, la
quantité d'information présente
sur les spectres n'est pas toujours suffisante pour
retracer les connexions de la chaîne
peptidique résidu par résidu. D'autre part,
la dispersion des déplacements chimiques des
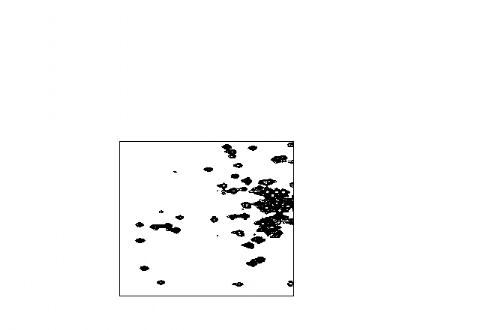
carbonyles étant faible (de l'ordre de 10 ppm),
le risque d'ambiguïtés et de recouvrement spectral en est plus
important. Ces deux types d'expériences ne constituent donc pas le
couple privilégié permettant l'attribution
séquentielle, mais apportent cependant une information
supplémentaire pour lever d'éventuelles
ambiguïtés.
HNCO
HN(CA)CO
|
|
H
|
O
|
H
|
H
|
O
|
|
H
|
O
|
H
|
H
|
O
|
|
A)
|
|
C
|
C
|
N
|
C
|
C
|
|
C
|
C
|
N
|
C
|
C
|
|
H
|
C
|
H
|
H
|
C
|
H
|
H
|
C
|
H
|
H
|
C
|
H
|
13CO
COX-1
13CO
COX-1
COY-1
B)
15N
COX
COY-1
COY
15N
HX HY
NY
NX
1HN
HX HY
NY
NX
1HN
Figure 3.5 : Expériences
3D de triple résonance utilisées pour l'attribution des
13CO d'une protéine. A) Schéma du transfert de
l'aimantation dans les expériences HNCO et HN(CA)CO. Les noyaux
édités en fréquence sont indiqués par des
cercles noirs, alors que ceux uniquement relayés, sont
indiqués par des cercles blancs. B) Exemple illustré de
spectres HNCO et HN(CA)CO correspondants à un segment de 2
résidus consécutifs X-Y ; mise en évidence de la
connectivité séquentielle.
c) Attribution des Câ
Les expériences CBCA(CO)NH et CBCANH sont sans aucun
doute les expériences majeures dans la stratégie
d'attribution. Elles fournissent les mêmes informations que le
couple HN(CO)CA et HNCA et de plus, mettent en évidence les
corrélations du groupement amide avec les 13Câ intra-
et inter-résidus (Figure 3.6). Outre l'apport d'une information de
fréquence supplémentaire, la connaissance du
déplacement chimique du 13Câ permet une
identification partielle du type de résidu, et de relier les
chaînes latérales à l'attribution séquentielle du
squelette.
Les deux expériences débutent de la même
façon : après transfert de l'aimantation des
protons aliphatiques vers leur carbone, l'aimantation provenant
du 13Câ est transférée au
13Cá
via la constante de couplage
1JCá-Câ (35 Hz). Elle est ensuite orientée
sélectivement vers le
15NH pour la CBCANH, ou vers le 13CO
(puis vers le 15NH) pour la CBCA(CO)NH. Au final,
l'expérience CBCANH fait apparaître les corrélations du
groupement amide avec les noyaux
13Cá et 13Câ des
résidus i et i-1, et la CBCA(CO)NH procure uniquement les
corrélations avec
les noyaux 13Cá et 13Câ du
résidu i.
CBCA(CO)NH
CBCANH
|
|
H
|
O
|
H
|
H
|
O
|
|
H
|
O
|
H
|
H
|
O
|
|
A)
|
|
C
|
C
|
N
|
C
|
C
|
|
C
|
C
|
N
|
C
|
C
|
|
H
|
C
|
H
|
H
|
C
|
H
|
H
|
C
|
H
|
H
|
C
|
H
|
13Cá/â
B)
CâX-1
CáX-1
HX HY
CâY-1
CáY-1
1HN
15N
NY NX
13Cá/â
CâX
CâX-1
CáX
CáX-1
HX HY
CâY
CâY-1
CáY
CáY-1
1HN
15N
NY NX
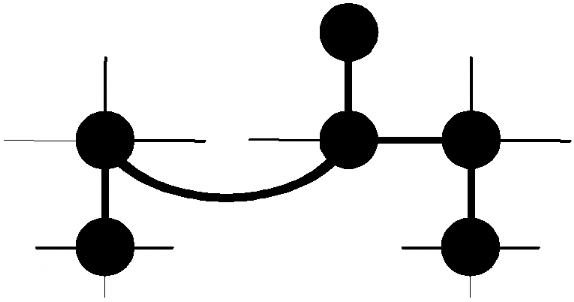
Figure 3.6 : Expériences
3D de triple résonance utilisées pour l'attribution des
13Câ d'une protéine. A) Schéma du transfert
de l'aimantation dans les expériences CBCA(CO)NH et CBCANH. Les
noyaux édités en fréquence sont indiqués par des
cercles noirs, alors que ceux uniquement relayés, sont
indiqués par des cercles blancs. B) Exemple illustré de
spectres CBCA(CO)NH et CBCANH correspondants à un segment de 2
résidus consécutifs X-Y ; mise
en évidence des connectivités
séquentielles.
1.2) Attribution des protons Há et
Hâ
Les 3 couples d'expériences décrits
précédemment ne sont pas toujours suffisants pour reconstituer
l'ensemble de la chaîne peptidique. En effet, certains
inconvénients inhérents à l'analyse d'une
protéine par RMN comme le recouvrement spectral, et la
dégénérescence partielle du signal, nuisent à la
qualité et à la quantité d'information présente sur
les spectres,
et ne permettent généralement pas de
relever la totalité des déplacements chimiques
13Cá,
13Câ, et 13CO des
résidus i et i-1 relatifs à chaque groupement
amide. L'attribution
séquentielle peut cependant être
complétée et vérifiée à partir du
déplacement chimique 1Há
fournit par les expériences 3D HNHA et HBHA(CO)NH.
L'expérience HNHA (Vuister & Bax, 1993) est
classiquement utilisée pour corréler le
groupement amide (1HN ; 15NH ) au seul proton 1Há
intra-résiduel. Cette expérience de double
i i i
résonance 1H, 15N ne
nécessite qu'un échantillon de protéine simplement
marquée 15N. Cependant, l'intensité des pics
observés sur les spectres est proportionnelle à la constante de
couplage 3JHN-Há, et pour des valeurs faibles, il est parfois
difficile d'observer une tache de corrélation. Cet
inconvénient ne se retrouve pas avec l'expérience
triple résonance HBHA(CO)NH (Grzesiek & Bax, 1993), qui permet de
relier chaque groupement amide aux noyaux 1Há et
1Hâ du résidu précédent (Figure 3.7). En
effet, cette expérience, plus sensible
que la HNHA, est tout à fait comparable à la
CBCA(CO)NH et met en jeu un transfert de
l'aimantation, via des couplages scalaires forts, de la
chaîne latérale i-1 au groupement amide
i via le noyau 13COi-1 non édité.
La combinaison des expériences HNHA et HBHA(CO)NH
permet donc d'identifier le déplacement chimique des protons
1Há des résidus i et i-1 relatifs à
chaque groupement amide, et ainsi de consolider l'attribution
séquentielle. Le déplacement chimique des protons
Hâi-1, dont l'ordre de grandeur fournit une
indication du type d'acide aminé, peut également
être utilisé pour contrôler l'attribution.
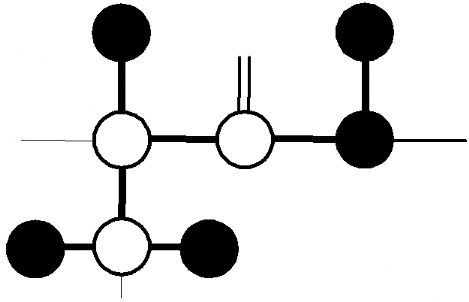
HBHA(CO)NH
1Há/â
Hâ2i-1
Hâ1i-1
H O
A) C C
H C H
H H O
N C C B)
H C H
Hái-1
15N
NHi
HNi
1HN
Figure 3.7 : Attribution des
protons 1Há et 1Hâ avec
l'expérience 3D de triple résonance HBHA(CO)NH. A)
Schéma illustrant le transfert de l'aimantation : les noyaux
édités en fréquence sont indiqués par des cercles
noirs, et ceux uniquement relayés, sont indiqués par
des cercles blancs. B) Illustration des corrélations
observables sur un spectre HBHA(CO)NH
pour un groupement amide i.
1.3) Attribution des chaînes latérales
1.3.1) Description des expériences 3D HCCH-COSY et
HCCH-TOCSY
Les expériences utilisées pour l'attribution des
chaînes latérales sont généralement des
expériences 3D de double résonance 1H et
13C. C'est le cas de la HCCH-COSY, et de la HCCH-TOCSY, qui
permettent d'identifier les protons et carbones des chaînes aliphatiques
et aromatiques (Kay et al., 1993 ; Majumdar et al., 1993) . Ces deux
expériences peuvent être interprétées comme des
2D 1H-1H COSY et TOCSY, et la troisième
dimension disperse l'information selon la fréquence du carbone
13C. Les chemins de cohérence suivis sont
cependant très différents de ceux
observés dans des expériences 2D homonucléaires
1H.
Ainsi, la séquence d'impulsions HCCH-TOCSY contient un
motif TOCSY 13C-13C pendant lequel l'aimantation est
transférée le long de la chaîne carbonée
(Figure 3.8). Comparé au TOCSY classique 1H-1H
basé sur les constantes de couplage 2JH-H et
3JH-H (4-10 Hz), ce type
de transfert est bien plus efficace car il repose sur le
couplage fort 1JC-C (35-55 Hz). Il en est
de même pour le transfert COSY
13C-13C de l'expérience HCCH-COSY qui est
basé sur cette même constante de couplage 1JC-C.
La bonne sensibilité de ces expériences s'explique
également par des transferts de cohérence rapides entre les
noyaux 1H et 13C via la constante
de couplage 1JC-H (125-250 Hz).
HCCH-TOCSY
1H
Häi
Hãi
H
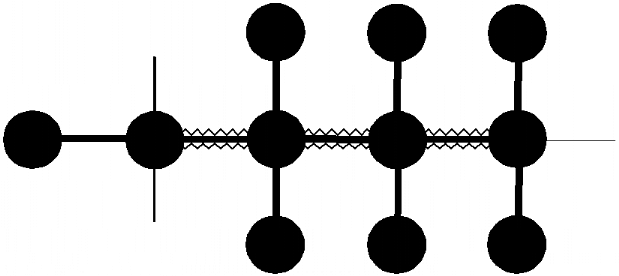
A) H
N H H H
C C C C B)
Hâi
Hái
13C
á â ã ä
Cãi
O C H H H
Hái
Hãi 1H
Cái
Figure 3.8 : Attribution
des noyaux 1H et 13C des chaînes
latérales aliphatiques et aromatiques. A) Description du transfert
de l'aimantation dans une expérience 3D de double résonance
HCCH-TOCSY. Les noyaux édités en fréquence sont
indiqués par des cercles noirs
et le transfert TOCSY 13C-13C est
indiqué par un trait ondulé. B) Exemple illustré de
spectre HCCH-TOCSY. Mise en évidence du système de spin de 2
protons Há et Hã appartenant au même résidu et
respectivement portés par les carbones Cá et Cã.
1.3.2) Attribution des chaînes latérales
aliphatiques
Les fréquences de résonance des noyaux
1H et 13C de chaîne latérale
aliphatique se déterminent à partir des spectres HCCH-TOCSY
et HCCH-COSY édités sur la région
aliphatique. Dans l'optique d'obtenir des spectres de
bonne qualité, il est préférable
d'enregistrer ces 2 expériences sur un échantillon
de protéine doublement marquée 15N / 13C,
préalablement lyophilisé, et repris dans 100 % de D2O. Les
valeurs de déplacement chimique
de 13Cá, 13Câ,
1Há et 1Hâ servent de point de
départ pour identifier les autres résonances
aliphatiques de chaîne latérale.
1.3.3) Attribution des chaînes latérales
aromatiques
Les raies de résonance des protons et
carbones de chaîne latérale aromatique s'attribuent en
deux étapes. Dans un premier temps, les systèmes de spin
aromatiques se déterminent à partir de l'expérience
HCCH-TOCSY, éditée sur la région aromatique, et
enregistrée sur un échantillon doublement marqué
en solvant D2O. Les valeurs de déplacement chimique
13C des cycles aromatiques sont spécifiques du type d'acide
aminé, ils permettent ainsi la distinction entre les
différents cycles. L'attribution de ces systèmes se
réalise ensuite en recherchant les nOe intra-résiduels qui
corrèlent les noyaux 1Há et 1Hâ aux
noyaux 1H aromatiques sur le spectre 13C-NOESY-HSQC,
édité sur la région aliphatique et enregistré sur
le même type d'échantillon.
Dans le cas du domaine K2, les expériences 3D
HCCH-COSY et HCCH-TOCSY suffisent pour identifier la
quasi-totalité des résonances aliphatiques et
aromatiques. Cependant, la forte similarité de
déplacement chimique de certains types de noyaux
aliphatiques 1H et 13C induit généralement
la présence de nombreuses zones de recouvrement
sur les spectres, qui ne permet pas toujours une attribution sans
ambiguïté. Pour une protéine
de cette taille, la stratégie peut alors consister
à enregistrer d'autres expériences de type 3D ou
4D, qui corrèlent les noyaux 1H ou
13C aliphatiques au groupement amide du résidu suivant
(Grzesiek et al., 1993 ; Logan et al., 1993).
| 


