CHAPITRE 2
Expression des protéines PRODH
sauvage et mature chez E. coli
L'expression des protéines PRODH sauvage et mature a
été réalisée au Laboratoire de
Génétique Moléculaire de l'EMI 9906
dirigé par le Professeur Thierry Frebourg, et en étroite
collaboration avec les chercheurs du Groupe d'Etude des Bases
Moléculaires de la Schizophrénie. Le détail des
protocoles expérimentaux relatifs au clonage, à la production,
et
à l'analyse de ces protéines figure à la fin
de ce chapitre dans la partie Matériels et Méthodes.
1) Production de PRODH sauvage
Comme nous l'avons définie dans le chapitre
précédent, la première étape de la stratégie
d'étude structurale de PRODH consiste à surexprimer la
totalité de la protéine sauvage
(1-600) chez la bactérie E. coli.
Pour cela, nous avons choisi d'utiliser le plasmide d'expression
pQE-31 de la société Qiagen qui permet de
produire des protéines recombinantes fusionnées à
une étiquette 6xHis en N-terminal (succession de 6
résidus histidine). Ce vecteur comporte dans sa région
promotrice un promoteur fort de type T5 à induction directe
à l'IPTG, suivi de 2 sites opéron lactose qui permettent sa
régulation par la protéine LacI. Après clonage du
plasmide par l'ADNc de PRODH sauvage, des souches
bactériennes BL21 contenant le vecteur pREP-4 (Qiagen) ont
été transformées par le plasmide pQE-31 cloné. Le
vecteur pREP-4 comporte le gène qui encode la protéine
de régulation LacI.
1.1) Caractérisation de l'expression et de la
solubilité de la protéine hétérologue
Les premiers tests de surexpression ont
été entrepris dans le but de caractériser
l'expression et la solubilité de la protéine recombinante.
La production de PRODH a été induite en erlenmeyer de 300
mL contenant 30 mL de milieu de culture LB par ajout de 1 mM d'IPTG à
une densité optique (DO) de 0.5. Des prélèvements
de 1 mL ont été réalisés à intervalles
de temps réguliers afin de suivre l'évolution de
l'expression. Pour chaque prélèvement, les cellules
bactériennes ont été lysées dans un tampon
phosphate à pH neutre et
les fractions contenant les protéines solubles et
insolubles ont été séparées par centrifugation.
Le culot contenant le matériel insoluble a
été repris avec un tampon phosphate contenant de l'urée 8
M à pH neutre, puis incubé à 4°C sous agitation
pendant 6 heures. Après une seconde étape de centrifugation, les
agrégats du culot final ont été finalement
solubilisés avec du SDS,
un détergent ionique dénaturant. Toutes les
fractions prélevées ont été analysées
par SDS-
PAGE et Western-blot (Figure 2.1). L'analyse Western-blot a
été réalisée avec un anticorps
anti-6xHis qui permet de révéler les
protéines qui présentent un amas de 6 résidus histidine en
surface.
t0 2H 4H 5H
t0 2H 4H 5H
(kDa)
91
50
fraction soluble
fraction urée 8M




t0 2H 4H 5H
2H 4H 5H
(kDa)
91
PRODH
PRODH
50
culot final
Western-blot
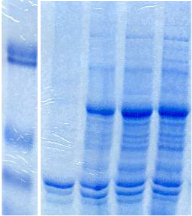
Figure 2.1 : Expression de PRODH
sauvage chez E. coli. Analyses SDS-PAGE des fractions
contenant les protéines solubles, les
protéines insolubles solubilisées dans l'urée et le culot
final repris avec du SDS, après 2 heures (2H), 4 heures (4H), et 5
heures d'induction (5H), et avant induction (t0). Les résultats de
l'analyse Western-blot du culot final sont également
présentés.
L'analyse SDS-PAGE du culot final fait apparaître une
bande de surexpression à une masse apparente de 70 kDa à partir
de 2 heures d'induction. L'intensité de cette bande, qui correspond
à la masse attendue de PRODH sauvage, est maximale lorsque le
temps d'induction atteint 4 heures. La révélation de cette
bande protéique par un anticorps anti-
6xHis confirme la présence de PRODH sauvage dans le culot
final (Figure 2.1). En ce qui concerne les fractions contenant les
protéines solubles et les protéines insolubles reprises dans
l'urée, aucune bande de surexpression correspondant
à cette masse apparente n'est clairement
discernable sur le gel SDS-PAGE. De plus, l'analyse Western-blot
par l'anticorps anti-6xHis,
qui est plus sensible qu'une coloration au bleu de
Coomassie, ne révèle aucune bande d'expression de
manière significative dans ces fractions (non
présenté). L'ensemble de ces résultats indique
clairement que la protéine PRODH sauvage est exprimée
sous forme insoluble chez E. coli dans ces conditions
d'expression.
| 


