1 .4. Constitution d'une pile à combustible :
Une pile à combustible est constituée d'un
empilement de cellules qui forment un `stack'. Ces cellules
élémentaires sont constituées de l'ensemble
électrode-membrane-électrode (EME) figure (1.3).

Figure (1.3) : `Stack' d'une pile à
combustible de type PEMFC [1, 8]
La figure suivante représente la structure d'une cellule
et d'un empilement.
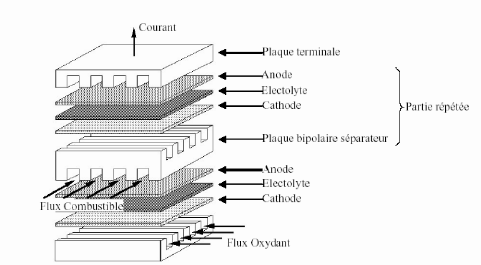
Figure (1.4) : Structure d'un empilement des
cellules PEMFC [Electro Encyclo] [4]
Cette figure met en évidence trois
éléments constitutifs d'une cellule : L'électrolyte (la
membrane dans le cas de la PEMFC), les électrodes (Anode, Cathode) et
les plaques.
1.4.1. L'électrolyte :
C'est l'élément principal de la pile a
combustible. Il permet que les espèces ioniques (et pas les
électrons) transitent de l'anode vers la cathode. Ces
électrolytes déterminent la température de fonctionnement
de la pile. Les caractéristiques de chaque type de pile sont leur
conductivité ionique, leur étanchéité aux gaz, leur
stabilité face aux réactifs chimiques et leurs
propriétés mécaniques. A cela s'ajoutent d'autres
contraintes selon le type de pile, le niveau de la température, les
composants des gaz, les espèces ioniques passant à travers
l'électrolyte ainsi que les conditions de pression. Les
différents types d'électrolyte seront traités sur chaque
type de pile [1,2]
1.4.2. Les électrodes :
Ils sont le siège des réactions
d'oxydoréduction, en plus ils ont une triple fonction:
· Supporter le catalyseur finement divisé et
permettre son contact avec les gaz.
· Permettre aux espèces protoniques de se
déplacer depuis les sites catalytiques d'oxydation de l'hydrogène
vers les sites où l'oxygène est réduit grâce
à la présence de polymère ionique.
· Evacuer les électrons des sites catalytiques
anodiques et redistribuer ces électrons sur les sites catalytiques
cathodiques [1, 2].
1.4.3. Catalyseur :
Le catalyseur est un métal utilisé pour
catalyser (accélérer) la réaction électrochimique
au niveau des électrodes, de plus, pour résister durablement la
corrosion (dissolution) dans cet environnement chimique très acide.
C'est pour cela, le métal le plus utilisé est du platine
(métal noble) pur ou allié à un élément de
transition (Cr, Mn, Ni, Co, Fe). [1, 2, 9]
-Les catalyseurs du coté anode :
Pour les piles de basse et moyenne température, on
utilise des métaux précieux: platine Pt, rhodium Rh,
ruthénium Ru ou palladium Pd; ou du Nickel de Raney. Les métaux
précieux sont répartis sur les électrodes en charbon actif
à très grande surface spécifique (noir
d'acétylène). Actuellement on utilise surtout du platine: celui
ci est réparti sous forme des particules de faible taille (2 nm).La
réaction de dissociation de l'hydrogène est assez complexe.
Ces électrodes sont très sensibles au CO (elles
ne supportent pas plus de 100 ppm) et au soufre, ce qui constitue un vrai
problème si on utilise de l'hydrogène issu du reformage: on
assiste alors à une diminution de la densité de courant
surfacique et donc de la puissance.
De nombreux travaux portent actuellement sur le remplacement
du platine jugé trop cher (80F/g) ou la diminution de la quantité
nécessaire: alliages de platine (Pt/Ru, Pt/Mb, Pt/Sn), terres rares...
Pour les piles de haute température, on peut utiliser des métaux
moins chers (Fer, Nickel, Cobalt) et on n'a pas de problème
d'empoisonnement au CO. [9]
- Les catalyseurs du côté cathode :
Pour les piles de basse et moyenne température, on
utilisera aussi des métaux précieux et certains métaux de
transition usuels (Chrome, Nickel), ou bien du charbon actif avec de l'or ou de
l'argent. Pour les piles de haute température, on peut utiliser soit du
Nickel fritté ou des oxydes mixtes. La réaction de
l'oxygène est aussi assez complexe.
Ces électrodes sont assemblées puis
collées de part et d'autre de la membrane par pressage à chaud.
L'ensemble électrode membrane électrode (EME) a une
épaisseur inférieure au millimètre. Cet ensemble EME est
intégré entre deux plaques bipolaires. [9]
| 


