III-3 Immobilisation des Ji-Glucosidases
L'utilisation des enzymes immobilisées présente
un grand intérêt pour différentes applications
industrielles notamment pour la production des sucres, des acides
aminés, et des drogues depuis plus de deux décennies (Saudagar et
Singhal, 2004). L'idée fondamentale d'immobiliser les enzymes est
d'inclure la protéine dans un support semi-perméable, qui
empêche l'enzyme de partir tout en permettant à des substrats,
à des produits, et à des cofacteurs de passer à travers.
Bien que les conditions exactes pour la matrice d'immobilisation sont
dictées par le type d'enzyme et l'application prévue, il est
clair que le matériel doit au moins être non dégradable et
compatible avec les enzymes. Le procédé pour l'immobilisation
doit également être assez doux pour ne pas dénaturer
l'enzyme pendant la préparation (Taqieddin et Amiji, 2004).
Il existe deux possibilités d'immobiliser des enzymes
:
Soit en tant qu'enzymes libres : ceci nécessite une
étape de purification induisant une perte partielle de celles-ci, mais
est idéale pour des enzymes sécrétées ;
49
Synthèse Bibliographique
soit en cellules entières : ceci est simple et
idéale pour des enzymes intracellulaires puisqu'elle évite les
étapes de purification. Cependant, des réactions parasites
peuvent interférer sur le produit et entraîner sa
dégradation.
L'immobilisation, d'une manière générale,
permet d'avoir une meilleure stabilité des enzymes, mais peut induire
des problèmes de diffusion et d'accessibilité au substrat
contrairement aux enzymes libres. L'immobilisation peut être
réalisée sur différents types de support, mais la plupart
des supports présentent l'inconvénient d'être chers. Les
principales méthodes pour préparer une enzyme immobilisée
incluent l'adsorption, l'inclusion, la liaison covalente et l'encapsulation
(Fig. 8). Quant aux matrices utilisées, on a principalement deux types
qui sont les plus employées (Saudagar et Singhal, 2004 ; Bai et Zhou,
2004) :
les polymères : l'agarose, la cellulose, les dextranes,
les polymères tels que le chlorure polyvinylique, les acrylates, les
nylons, le polystyrène. La matrice de polymère est
aisément fonctionnelle et l'attachement de la protéine s'effectue
facilement ;
les matériaux inorganiques : la silice sous forme de
billes de verre microporeuses et de gel de silice, peuvent doter les enzymes
immobilisées des propriétés mécaniques sur la
stabilité de pression.
Des hybrides de ces matières premières telles
que l'amide d'agarose-acryl et la silice polymère-enduite ont
été également employés pour l'immobilisation des
enzymes.
L'alginate est de loin le polymère le plus largement
répandu pour les technologies d'immobilisation et de
micro-encapsulation. L'alginate est un extrait d'algue composé de
chaînes alternant les résidus d'acide á-L-guluronique et
d'acide â-D-mannuroniques. Les supports d'alginate sont habituellement
faits en réticulant le groupe carboxylique de l'acide
á-L-guluronique avec un ligand cationique tel que le chlorure de
calcium, le chlorure de barium, ou le poly-(L-lysine). Les matrices d'alginate
réticulées avec des ions de Ca2+, sont cependant
instables dans l'environnement physiologique ou dans les solutions tampons
communes ayant une concentration élevée en ions phosphate et
citrate qui peuvent extraire les ions Ca2+ à partir de
l'alginate et liquéfient le système (Taqieddin et Amiji,
2004).
Synthèse Bibliographique

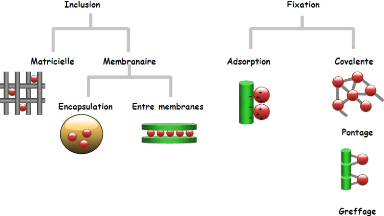
Figure 8 : Différentes méthodes
d'immobilisation.
50
Les enzymes immobilisées déjà
présentent sur le marché ont plusieurs avantages au niveau de
leurs utilisations industrielles, mais également quelques
inconvénients (Tableau 3).
Tableau 3 : Avantages et inconvénients
des enzymes industrielles immobilisées (Demirel et al.,
2004).
|
Avantages
|
Inconvénients
|
· Économie d'énergie
|
· Problèmes liés à la
dénaturation des
|
· Équipements adaptés...
|
enzymes
|
· Très haute spécificité
enzymatique
|
· Prix élevé de certaines applications
|
· Conditions douces d'utilisation (pH,
|
· Nécessité de co-facteurs (Ca2+,..) pour
|
T°C)
|
certaines réactions
|
· Peu de problèmes de stockage des
|
· Contrôle et ajustement du pH
|
préparations enzymatiques
|
· Milieux réactionnels variés induisant
des
|
· Catalyseurs actifs à faibles doses
|
mécanismes enzymatiques complexes :
|
· Très haute vitesse de réaction et
contrôle
|
- Catalyse homogène en milieux aqueux
|
facile
|
- Catalyse hétérogène (substrats
insolubles,
|
· Synthèses
stéréospécifiques,...
|
réactions en milieu organique)
|
· Biodégradables
|
|
|
Synthèse Bibliographique
IV- Trametes trogii
Trametes trogii est un des basidiomycètes de
pourriture blanche le plus universel. Il a été
démontré un producteur intéressent de laccase et d'autres
enzymes ligniniolytiques incluant MnP et LiP (Ellouze et al., 2008).
La laccase est une enzyme secrétée par divers
basidiomycétes dégradant la lignine (Kahraman et Gurdal, 2002),
et elle a été démontré comme une enzyme essentielle
pour la dégradation de lignine par les champignons sans peroxydases
(Eggert et al., 1997). Cette enzyme catalyse différentes
réactions de bioconversion à savoir, l'oxydation de nombreux
composés phénoliques et des amines aromatiques en exigeant un
médiateur, tout en utilisant par ailleurs une variété de
composés non phénoliques jouant le rôle de substrats.
V- Trichoderma atroviride
Trichoderma atroviride est un ascomycète, et
un mycoparasite effectif, fort et puissant. Il est à l'origine de divers
pathogénies de plantes impliquant des modifications morphologiques, des
secrétions enzymatiques et des antibiotiques (Reithner et al.,
2007). Un travail ultérieur de Kovács et al. (2008) a
décrit la sécrétion d'un nouveau microorganisme
cellulotique « Trichoderma atroviride » dans le sol
prétraité tout en produisant des cellulases et des
â-glucosidases dans ce matériel végétal.
51
52
Synthèse Bibliographique
Les techniques séparatives
membranaires
| 


