V- Caractérisation des propriétés de
l'enzyme immobilisée
V-1 Introduction
En général l'immobilisation des enzymes leur
confère les caractéristiques suivantes:
? augmentation de leur stabilité dans le temps,
? élargissement du domaine d'utilisation vis à vis
des conditions de température et de
pH,
? facilité de séparation en vue d'une
réutilisation,
? possibilité de mise en oeuvre de procédés
continus
V-2 Effet de la température et le pH sur l'enzyme
immobilisé
L'immobilisation permet d'améliorer la
résistance de l'enzyme aux conditions qui lui sont normalement
néfastes. Nous avons donc testé les effets de la
température et du pH sur l'activité immobilisée dans les
mêmes conditions que l'enzyme native. Une étude comparative de
l'effet de la variation de la température sur l'enzyme libre et
immobilisée a été effectuée. La température
a été variée de 30 °C à 60 °C. Les
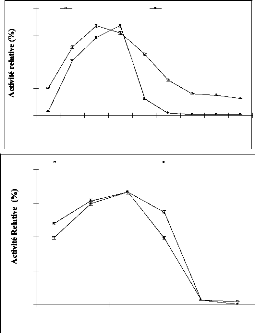
résultats relatifs à cette étude sont illustrés sur
la Fig. 37 a. La même comparaison des deux formes d'enzyme a
été effectuée en raisonnant sur le pH. La gamme de pH
varie de 2 à 10. Les résultats relatifs à cette
étude sont
126
Résultats et Discussion
illustrés sur la Fig. 37 b. Sur la Fig. 37, nous
observons qu'une fois immobilisée elle présente une
activité sur une gamme de température et de pH plus
importante.
a
90
60
30
0
120 Enzyme immobilisée Enzyme libre
2 3 4 5 6 7 8 9 10
pH
b
120
90
60
30
0
Température °C
30 40 50 60 70 80
Enzyme immobilisée Enzyme libre
Figure 37: Comparaison de l'effet de la
température et du pH entre â-glucosidase libre
et
immobilisée sur l'alginate de calcium. a :
Température. b : pH.
Dans le cas de la température, l'activité subit
une perte d'activité de l'ordre de 30% à 60 °C (Fig. 37 a)
alors que pour le pH la perte d'activité est observée à un
pH 5,5 et 10 (Fig. 37 b) pour l'enzyme libre. En revanche, suite à son
encapsulation dans des billes d'alginate de calcium, l'enzyme
immobilisée permet d'améliorer l'activité enzymatique
à 60 °C de 23% et au pH 6 de 50%. Seulement la chute
d'activité de l'enzyme libre était légèrement plus
prononcée aux acidités élevées, une
caractéristique a été aussi observé par Nagatomo
et al., (2005). Ceci peut être provisoirement attribué au
rôle protecteur du microenvironnement entourant le biocatalyseur. De plus
; des modèles grossièrement semblables ont été
obtenu, où le profil du pH optimum n'est pas significativement
changé avec l'immobilisation. Ceci a été annoncés
précédemment par Nagatomo et al., (2005). D'autre part, un
changement de l'optimum pH de 5 à 4 a été observé
comme le résultat d'immobilisation dans l'alginate. Chang et Juang
(2007) ont aussi annoncé un changement vers un environnement plus acide
suite à l'immobilisation de â-glucosidase dans des supports de
chitosan-argile.
127
Résultats et Discussion
L'enzyme immobilisée est montrée efficace
jusqu'à 55°C, sans fuite d'enzyme observée, mais au-dessus
de cette température, la fonte du support a été
observée. Ce comportement postérieur a été aussi
annoncé (Rebro et al., 2007) et empêché la nouvelle
évaluation de ce support aux températures plus hautes, à
savoir, jusqu'à 65°C. Au-dessus de cette température, il y a
une chute aiguë d'activité de l'enzyme libre. En revanche, Chang
& Juang (2007) ont annoncé une gamme de tolérance plus haute
à la chaleur de â-glucosidase immobilisée sur des
composés d'argile quand comparés à l'enzyme libre. Les
températures optimales d'enzymes libres et immobilisées
étaient de 50 °C. Martino et al., (1996) et Synowiecki et
Wolosowska (2006) ont aussi annoncé une tolérance accrue vers la
chaleur suite à l'immobilisation bien que sans changements dans la
température optimale.
| 


