CHAPITRE I :
ETUDE BIBLIOGRAPHIQUE
INSAT Chapitre I : Etude
bibliographique
2012-2013 13
I. Notions sur les médicaments I.1.
Généralités
I.1.1. Définitions et compositions
Le code de la santé publique définit le
médicament comme étant toute substance ou composition
possédant des propriétés curatives ou préventives
à l'égard des maladies humaines ou animales, permettant de
restaurer, corriger ou modifier les fonctions physiologiques en exerçant
une action pharmacologique, immunologique ou métabolique.
Les médicaments sont généralement
constitués de principe(s) actif(s) et d'excipients. Le principe actif
est une substance présentant une action thérapeutique. Les
substances actives peuvent être des éléments ou des
composés chimiques ainsi que des mélanges et solutions naturels
qui sont issus d'origine microbiennes (les vaccins), végétales ou
animales. Les substances actives peuvent aussi être obtenues par
synthèse chimique ou par des techniques de biotechnologie [1].
Les excipients sont des composants sans action
pharmacologique, nécessaires à la fabrication, à la
conservation et à l'administration des médicaments. Ils servent
de support à la matière active dont les quantités seraient
souvent trop faibles pour être facilement administrées. L'un des
rôles majeurs des excipients est notamment de donner une forme au
médicament, lui conférer un goût particulier et de garantir
sa stabilité [1].
I.1.2. Notions des génériques
Lorsqu'un laboratoire découvre un médicament, il
le protège par un brevet qui lui assure l'exclusivité
commerciale, et ce pendant 20 à 25 ans. Au-delà de cette
période, la licence de fabrication de ce médicament de
référence (ou princeps) tombe dans le domaine public. Un autre
laboratoire peut alors commercialiser un médicament
générique comparable à celui-ci.
Sa formulation présente la même composition
qualitative et quantitative en principe(s) actif(s) et la même forme
pharmaceutique qu'une spécialité de référence
déjà
INSAT Chapitre I : Etude
bibliographique
2012-2013 14
existante. Seuls les excipients peuvent varier, ce qui peut
entraîner de nouveaux effets secondaires ou certaines contre-indications,
comme les allergies.
La firme productrice n'a aucun frais de recherche et de
développement de ce fait le frais de remboursement des
génériques est inférieur à celui du princeps, ce
qui en fait son intérêt [1].
I.1.3. Formes galéniques des médicaments
Le terme de «galénique » provient du nom de
Claudius Galenus (Galien), médecin ayant vécu au
IIème siècle av. J-C à Rome. Il s'est
intéressé tout particulièrement à la formulation et
à la préparation des médicaments.
Avant la mise sur le marché, chaque médicament
doit faire l'objet d'une étude de composition, de forme et de
présentation qui convienne le mieux à son administration,
permettant ainsi de garantir la précision du dosage et une
stabilité satisfaisante pendant une durée
déterminée [2].
La forme galénique la mieux adéquate sera le
compromis entre :
? la meilleure efficacité thérapeutique ;
? la meilleure tolérance clinique ;
? la meilleure observance ;
? le plus faible coût de traitement.
On distingue plusieurs formes galéniques dont chacune est
adaptée à une voie
d'administration [3] :
Voie orale
· comprimés
· capsules
· suspensions...
Voie cutannée
· lotions
· mousses
· pommades...
Voie parentérale
· préparartions injectables
· implants
Voies
d'adminisrattion
&
formes
galéniques
appropriées
Voie transmuqueuse
· collutoires
· pommades
· suppositoires...
Fig- 1 : Les formes galéniques et leurs
voies d'administration
INSAT Chapitre I : Etude
bibliographique
2012-2013 15
I.2. Formes orales solides : Les comprimés
I.2.1. Définition
Selon la Pharmacopée française, les
comprimés sont des préparations solides contenant une
unité de prise d'une ou plusieurs substances actives. Ils sont obtenus
en agglomérant par compression un volume constant de particules. C'est
la forme galénique la plus répandue sur le marché.
I.2.2. Types de comprimés
Il existe plusieurs types de comprimés dont on distingue
:
· Les comprimés non enrobés
Ils comprennent des comprimés à couche unique
et des comprimés à couche multiples disposées
parallèlement ou concentriquement. Très peu de substances sont
directement compressibles, il est donc nécessaire de leur adjoindre des
adjuvants agglutinants ou de réaliser une opération de
granulation. Ces deux méthodes permettent de garantir une
cohésion suffisante entre les grains et un délitement plus
facile.
? Les comprimés enrobés
Ce sont des comprimés dont la surface est recouverte
d'une ou plusieurs couches de mélanges de substances diverses comme les
résines, les gommes, la gélatine, les sucres, les cires, les
polyols et les colorants.
? Les comprimés effervescents
Leur délitement est assuré par un
dégagement d'anhydride carbonique résultant de l'action d'un
acide organique sur un carbonate. Ils sont destinés à être
dissous ou dispersés dans l'eau avant administration.
? Les comprimés orodispersibles
Ils sont constitués de nombreuses microparticules
enrobées qui sont comprimés entre elles. Elles se
désagrègent dans la bouche au contact de la salive et le principe
actif est résorbé dans le tractus digestif.
· INSAT Chapitre I : Etude
bibliographique
2012-2013 16
Les comprimés gastro-résistants
Ce sont des comprimés à libération
modifiée, destinés à résister aux sucs gastriques
et à libérer le ou les principes actifs dans les sucs
intestinaux. Ils sont obtenus soit en recouvrant les comprimés d'un
enrobage gastro-résistant, soit en les préparant à partir
de granulés déjà recouverts par une couche protectrice.
Ils sont utilisés pour les principes actifs irritants pour l'estomac ou
ceux qui peuvent s'altérer en milieu acide [3].
I.2.3. Avantages
Les formes pharmaceutiques destinées à
l'administration par voie orale et plus particulièrement les formes
sèches représentent plus de 80 % des médicaments produits
à l'échelle mondiale. Elles sont économiquement
intéressantes et hautement reproductibles grâce à la
maitrise des procédés industriels de leur fabrication. Les
comprimés et les capsules présentent la catégorie la plus
fréquemment produites et consommée parmi les autres formes
solides. Les principaux avantages de ces formes sont :
· l'auto-administration ;
· l'existence de différentes méthodes de
fabrication ;
· la commodité lors de l'emballage et du stockage
;
· la production en masse à faible coût ;
· la qualité constante et la précision du
dosage ;
· la stabilité plus satisfaisante comparativement
à la forme liquide ;
· la possibilité d'adaptation du profil de
dissolution par un système de libération prolongée [4].
I.2.4. Processus de fabrication
La fabrication des comprimés peut se faire selon deux
procédés différents. La figure (2) résume les
différentes étapes de chaque mode de production [5].
Les divers constituants, sous forme de poudres, sont
mélangés à l'aide de malaxeurs. Ils sont ensuite
préparés soit par une compression directe soit par une
granulation.
INSAT Chapitre I : Etude
bibliographique

a) Compactage
b) Concassage
c) Tamisage
Mélange des poudres de principe(s)
actif(s) et
d'excipients

Granulation humide
Granulation sèche
Mélange
Compression
a) Mouillage
b) Granulation
d) Séchage
c) Tamisage
2012-2013 17
Fig- 2 : Processus de fabrication des
comprimés
? La compression directe
Cette technique réduit le nombre d'opérations de
fabrication et diminue donc les coûts d'obtention ; mais requiert des
excipients onéreux et une technicité de mise au point
supérieure. Elle ne peut être mise à profit qu'avec des
comprimés à très faibles teneurs en principe(s)
actif(s).
? La granulation
Elle sert à augmenter la densité, à avoir
un meilleur écoulement, à obtenir une porosité
supérieure facilitant la dissolution ainsi qu'une meilleure
compressibilité.
Elle est réalisée soit pour voie humide, soit par
voie sèche : - La granulation par voie humide
Le liquide de mouillage est souvent de l'eau seule ou
additionnée de l'alcool dilué. Le mouillage est assuré
dans les malaxeurs des mélangeurs planétaires, à vis ou
autre types d'appareils.
INSAT Chapitre I : Etude
bibliographique
2012-2013 18
La granulation qui suit est réalisée dans les
granulateurs rotatifs ou oscillants et suivie d'une opération de
séchage en étuve ou dans des séchoirs à lit
fluidisé. Les granulés sont ensuite tamisés,
mélangés aux adjuvants avant de faire l'objet de la compression
définitive.
- La granulation par voie sèche
Plus rarement employée, elle est destinée
à la formulation de principes actifs ne supportant ni l'humidité
ni la chaleur du séchage. On réalise une compression
préliminaire, avec obtention de briquettes qui sont ensuite
concassées dans les broyeurs.
? L'enrobage
L'opération d'enrobage consiste à recouvrir la
surface des comprimés par une substance filmogène. Elle est
réalisée soit par dragéification ou pelliculage ; afin
d'obtenir un effet particulier comme la gastro-résistance ou la
libération prolongée, de masquer un goût
désagréable ou encore de fournir une coloration distinguée
pour des raisons commerciales. La pelliculage est la méthode est la plus
utilisée grâce à sa rapidité, son automatisme et
surtout son faible coût.
? Le contrôle
Lors de la fabrication, on contrôle le grain
(homogénéité, humidité résiduelle,
fluidité) et quelques propriétés des comprimés
obtenus telles que la dureté, l'aspect macroscopique, les dimensions
(épaisseur, diamètre) ainsi que la masse [5].
I.3. Excipients
I.3.1. Rôles d'excipients dans les formes solides
Le concept traditionnel de l'excipient a connu une
évolution importante d'une simple charge à un constituant
essentiel de la formulation. La qualité des médicaments est
déterminée non seulement par la substance active mais aussi par
la performance des autres constituants.
Leurs propriétés physicochimiques agissent
principalement sur trois axes [6]: - in vivo : ils définissent le temps
de la transition gastro-intestinale ;
INSAT Chapitre I : Etude
bibliographique
2012-2013 19
- au niveau du processus de fabrication : ils sont
indispensables pour la mise en forme galénique ;
- pendant le stockage : ils assurent la conservation.
Le développement rapide des facteurs scientifiques,
réglementaires et économiques a introduit un nouvel
intérêt pour le rôle et la fonctionnalité des
excipients. Plus d'un millier de matières premières, disponibles
à partir d'une multitude de sources, sont utilisés aujourd'hui
dans l'industrie pharmaceutique. Leurs structures chimiques varient de petites
molécules complexes naturelles à des molécules
synthétiques qui sont généralement des
polymères.
La sélection des excipients se base sur deux
critères déterminants de la qualité d'un médicament
: la stabilité et la biodisponibilité de la substance active. Ils
remplissent d'importantes fonctions en particulier dans le cas des formes
posologiques solides [7].
I.3.2. Classification
Les excipients jouent plusieurs rôles en
galénique. Ils sont utilisés à des teneurs massiques
différentes qui dépendent à la fois de la famille
d'excipients à laquelle ils appartiennent et de leur nature chimique
[8,9].
Ils sont classés suivant leurs fonctions au sein de la
préparation solide :
? Les diluants (20% - 90%) :
Ce sont des poudres généralement inertes, ils
jouent un rôle de remplissage lorsque la quantité de principe
actif est insuffisante pour la préparation de comprimés.
A titre d'exemple, on cite :
- les sucres : lactose, mannitol, saccharose ;
- les sels : phosphate dicalcique, tricalcique, sulfate de
calcium, carbonate
de calcium, chlorure de sodium ;
- l'amidon natif ;
- la cellulose microcristalline.
? Les liants ou agglutinants (5% - 10%) :
Certains jouent un rôle au niveau de la compression
directe tel que la cellulose microcristalline, et d'autres sont utilisés
pour la granulation humide tel que les dérivés
INSAT Chapitre I : Etude
bibliographique
2012-2013 20
vinyliques comme le polyvidone ou povidone (PVP). On trouve
entre autre les dérivés cellulosiques, les amidons, les
polyethylene-glycols (PEG), les dérivés glycéridiques
(D-glucose, maltose, sorbitol), les protéines (gélatine) et les
gommes.
? Les désagrégeants ou délitants (0,5% -
10%) :
Ils accélèrent la désintégration
du comprimé en fragments, dispersant ainsi une certaine quantité
du principe actif dans le milieu physiologique. Ils agissent selon divers
procédés : par gonflement, par dissolution ou par réaction
chimique. On cite comme exemple : la crospovidone, la croscarmellose
carboxyméthylamidon sodique.
? Les lubrifiants (0,5% - 15%) :
Ils donnent un aspect brillant et non poussiéreux aux
comprimés. Ils influencent les propriétés
rhéologiques des granulés et les opérations de compression
:
- ils améliorent la fluidité du grain en
favorisant l'alimentation régulière de la chambre de compression
et promouvant les propriétés rhéologiques du
mélange : c'est le cas de la silice;
- ils diminuent les problèmes de collage au niveau des
poinçons de la matrice de compression en réduisant
l'électricité statique de certaines poudres. C'est le pouvoir
anti-adhérent ou antistatique : exemple du talc;
- ils réduisent la friction entre les particules durant
la compression et diminuent les frottements : exemple du stéarate de
magnésium.
Les lubrifiants les plus couramment utilisés sont: le
stéarate de magnésium, l'acide stéarique, les
dérivés glycériques, la paraffine solide, le
polytetrafluoroethylène, le talc, l'huile de ricin et de coton
hydrogénée, le laurylsulfate de sodium et la silice pure
colloïdale.
? Les adjuvants divers :
Ils sont classés selon plusieurs familles :
- les mouillants : compensent les propriétés
hydrofuges de certains constituants ;
- les substances tampons: ont pour rôle de
protéger les principes actifs contre les variations du pH au cours de la
conservation. Exemple, le citrate ou phosphate de calcium ;
- les colorants : améliorent l'aspect du comprimé
;
INSAT Chapitre I : Etude
bibliographique
2012-2013 21
- les aromatisants et les édulcorants: atténuent
les saveurs désagréables ;
- les conservateurs : permettent la conservation du
comprimé et donc d'augmenter sa durée de vie en retardant
l'oxydation ou la photolyse du principe actif et des excipients ainsi que la
prolifération microbienne. Ce sont essentiellement des antioxydants et
antimicrobiens : acide citrique et acide ascorbique. On distingue aussi des
agents opacifiants qui protègent les principes actifs photosensibles des
rayonnements lumineux comme le dioxyde de titane.
II. Interactions physico-chimiques principe
actif-excipients
II.1. Définition de la notion
d'interaction
Une interaction est une influence réciproque entre
deux entités ou deux phénomènes. Dans le domaine
pharmaceutique, une interaction peut avoir lieu entre un principe actif et les
excipients ou entre les excipients eux-mêmes dans une même
formulation.
Les approches rationnelles de choix des excipients ont
été basées sur la probabilité potentielle de leurs
interactions avec les principes actifs. Plusieurs études ont
souligné l'existence des interactions comme la complexassion, la liaison
hydrogène, les interactions ion-dipôle, dipôle-dipôle
et de van der Waal. Ces dernières peuvent modifier le comportement
physicochimique, pharmacologique ou pharmacocinétique des
médicaments.
Par conséquent, les excipients sont des composantes
importantes pouvant soit améliorer les caractéristiques des
formulations soit réduire l'efficacité de certaines
préparations [10].
II.2. Méthodes d'étude d'interactions
principe actif-excipients
Un élément clé de la qualité du
médicament est le profil de stabilité qui constitue une rubrique
particulière du dossier d'Autorisation de Mise sur le Marché
(AMM).
La stabilité découle de l'ensemble des
données physiques et chimiques acquises tout au long du
développement du médicament et au cours de son stockage. Elle se
base sur la capacité du produit à demeurer conforme aux
critères d'acceptation en assurant sa qualité
thérapeutique et sa pureté durant une période de
conservation spécifiée.
INSAT Chapitre I : Etude
bibliographique
2012-2013 22
Cette dernière dépend essentiellement de
l'environnement chimique du principe actif, renfermant les excipients. Les
études de compatibilité principe actif-excipient sont
indispensables pour la maîtrise de la stabilité des produits
finis. Elles se font généralement sous des conditions de stress
à savoir la température, l'humidité et les mélanges
binaires ou ternaires, afin de prévoir tous types d'interactions
potentielles dans un laps de temps restreint (par rapport à la
durée de la validité du médicament avant sa
péremption).
L'étude de la stabilité se fait par plusieurs
méthodes : spectroscopiques, microscopiques, thermiques et
chromatographiques [6].
II.3. Types d'interactions principe
actif-excipients
Le choix des excipients et leurs interactions avec le
principe actif sont les bases de la formulation des médicaments :
l'ampleur de leurs effets sur le dosage libéré de la substance
active dépend de ces caractéristiques ainsi que de la
quantité et les propriétés des excipients [11].
Il peut s'agir d'une synergie entre les différents
constituants : l'interaction dans ce cas est considérée comme
étant bénéfique [12] ; on observe par exemple une
augmentation de la stabilité [13] et de la solubilité [14-16].
Les cas d'incompatibilité causent l'altération
de l'activité thérapeutique qui peut se traduire par
l'augmentation des effets indésirables ou la diminution significative de
la biodisponibilité [10, 17].
II.4. Incompatibilités physicochimiques principe
actif- excipients II.4.1. Incompatibilités chimiques
Les principes actifs sont généralement des
molécules fragiles, assez influençables par leur environnement
chimique. Deux catégories d'incompatibilité chimique sont
distinguées :
? les réactions de dégradation intrinsèque
de la substance active ; ? les réactions covalentes entre le principe
actif et les excipients.
INSAT Chapitre I : Etude
bibliographique
2012-2013 23
Les réactions de la première catégorie
sont favorisées par les excipients. En effet, ces derniers sont
déterminants de deux facteurs importants à savoir : la
présence d'une quantité d'eau plus ou moins importante et le
micro-pH local.
L'existence d'excipients hygroscopiques peut favoriser
l'augmentation de la concentration en impuretés. En effet,
l'humidité résiduelle dans un système à
l'état solide peut avoir un impact significatif sur la stabilité
du principe actif.
D'une part, elle augmente la plasticité et la
mobilité de ce système par conséquent sa
réactivité. Dans ce cas, l'incorporation d'excipients à
caractère hygroscopique (isolant l'humidité) empêche
l'hydrolyse de la substance active; comme la silice colloïdale par
exemple.
D'autre part, la quantité d'eau emmagasinée par
l'excipient, étant faiblement adsorbée à sa surface, reste
mobile et cause ainsi l'altération du médicament ; on cite le cas
de la cellulose microcristalline qui a favorisé la dégradation du
nitrozepam [18].
Les excipients peuvent posséder aussi un comportement
acido-basique selon leurs structures chimiques. Leurs critères de choix
doivent dépendre de la compatibilité de leur profil de pH avec la
fragilité des principes actifs. En outre, l'humidité libre
favorise la réactivité acido-basique à l'interface
principe actif-excipient. En effet, la majorité des médicaments
sont commercialisés sous la forme de sels car ils sont plus stables que
les bases ou les acides organiques correspondants. La modification du pH du
microenvironnement de principe actif régénère des formes
acides ou basiques libres et par la suite augmente la probabilité de sa
dégradation [18].
On cite à titre d'exemple la réaction
d'hydrolyse du principe actif, telle que celle d'un nitrile en amide, d'un
ester en acide et alcool, ou la réaction d'oxydation telle que celle
d'un thiol en disulfure, d'un alcool en cétone ou d'un aldéhyde
en acide [19].
En ce qui concerne les réactions covalentes entre le
principe actif et les excipients, ces dernières font intervenir des
groupements fonctionnels des excipients ou des impuretés pouvant
interagir avec la molécule thérapeutique.
INSAT Chapitre I : Etude
bibliographique
2012-2013 24
L'exemple type est la réaction de Maillard entre des
amines primaires ou secondaires et les sucres réducteurs. Le
schéma suivant présente le mécanisme de la réaction
entre le lactose et un principe actif portant une amine primaire [20] :
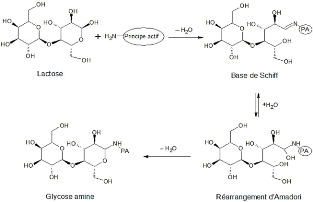
Fig- 3 : Réaction de Maillard entre
l'amine primaire d'un
principe actif et le lactose
Les réactions d'oxydoréduction ou de photolyse
sont initiées par le dioxygène en présence de la
lumière, d'un catalyseur ou de la chaleur, induisant la formation de
radicaux libres.
La polymérisation est une autre réaction qui
peut avoir lieu à cause des groupements fonctionnels portés par
les molécules. Elle mène à des entités chimiques
à poids moléculaires plus importants. Dans le cas de
l'ampicilline, l'amino-pénicilline en solution concentrée, subit
une polymérisation qui peut détruire le pouvoir
thérapeutique de ce principe actif.
L'isomérisation peut survenir avec certains types
d'excipients générant des impuretés ; c'est le cas de la
vitamine A.
Les excipients ionisables peuvent interagir avec des principes
actifs ionisables provoquant la formation de composés insolubles
résultant des interactions de charges entre les différents
composés (échange de contre-ion).
INSAT Chapitre I : Etude
bibliographique
2012-2013 25
Les bentonites et les attapulgites qui sont des
minéraux dont la surface est chargée peuvent interagir avec des
molécules thérapeutiques de charges opposées [19].
II.4.2. Incompatibilités physiques
Certains composés peuvent s'adsorber à la
surface du principe actif favorisant sa dissolution. Par contre, si les forces
d'attraction sont fortes, la libération du principe actif devient plus
difficile. C'est le cas des excipients lipophiles comme les lubrifiants tel que
le stéarate de magnésium qui peut former des
agglomérations autours des molécules actives [19].
II.5. Cas d'incompatibilités
présentées par les bétabloquants
Les bétabloquants, comme tous les principes actifs,
portent plusieurs groupements fonctionnels lui permettant d'accomplir leurs
rôles thérapeutiques. Cette fonctionnalité est à
l'origine, dans certains cas, d'incompatibilités avec différents
excipients.
Plusieurs études publiées portent sur l'analyse
du comportement de l'aténolol avec différents excipients. Cette
substance active a montré qu'elle est susceptible d'établir des
liaisons hydrogène avec le mannitol (entre l'hydroxyde du sucre et
l'hydrogène de l'amine secondaire de l'aténolol) ; cette
incompatibilité a été mise en évidence par une
température et une énergie de fusion plus importante que celle du
principe actif seul [21].
D'autres excipients ont engendré sa
décomposition, comme le lactose, via la réaction de Maillard avec
un taux de dégradation de 2%. De plus, l'acide ascorbique, l'acide
citrique et le butyl hydroxyanisole provoquent l'oxydation de
l'aténolol.
En effet, ces réactions augmentent parfois la
concentration en impuretés connues dans la monographie de la substance
active ou fait apparaitre des nouveaux produits de dégradations.
L'impureté (G) de l'aténolol, par exemple, est produite par
l'hydrolyse de sa fonction amide en présence des deux acides
cités précédemment [22].
Le carvédilol s'est avéré aussi
incompatible avec l'acide citrique : l'interaction entre les deux substances
produit l'ester de l'acide citrique et l'amide du principe actif [23].
INSAT Chapitre I : Etude
bibliographique
2012-2013 26
III. Phénomènes de polymorphisme dans les
médicaments III.1. Principe actif : état cristallin et
polymorphisme
Le polymorphisme est défini comme étant la
faculté que possède une substance de cristalliser selon des
structures différentes.
Ce phénomène concerne les médicaments de
formes solides. Les différentes opérations mécaniques,
chimiques et/ou galéniques prenant place après la cristallisation
auront, en général, des répercussions négatives sur
ce qu'il est convenu d'appeler la cristallinité initiale du principe
actif. En effet, la forme cristalline initialement obtenue peut évoluer
en subissant des transitions solide-solide incluant des transformations
polymorphiques, pseudopolymorphiques (formation d'hydrates ou de solvates) ou
devenir amorphe [24].
III.2. Facteurs provoquant le polymorphisme
Au cours du processus de fabrication, plusieurs
paramètres peuvent contribuer à la survenance du
polymorphisme.
Un principe actif, en vue de préparer des
gélules ou des comprimés, peut subir l'effet de
différentes opérations mécaniques incluant : le broyage,
le compactage et la compression.
Toute ces opérations mécaniques peuvent apporter
de l'énergie au système concerné par :
- un échauffement pouvant conduire à la fusion
de certaines entités du mélange ;
- un changement de la structure cristalline en favorisant soit
l'apparition d'une nouvelle forme cristalline soit l'amorphisation plus au
moins totale du principe actif et/ou des excipients. Il est important de noter
que même si le taux global de phases amorphes est faible et parfois
indétectable. Ces phases sont souvent présentes à la
surface des particules ;
- par la création de défauts cristallins qui
sont des zones localisées de hautes énergies pouvant favoriser
les processus de recristallisation en des phases plus stables [25].
D'une part, au niveau d'une formulation galénique
incluant un procédé de granulation humide ou avec un solvant, une
hydratation ou solvatation peut se produire : c'est le
INSAT Chapitre I : Etude
bibliographique
2012-2013 27
pseudopolymorphisme. D'autre part, ce phénomène
dans la majorité des cas est réversible. En effet, par un simple
chauffage, les pseudopolymorphes obtenus peuvent évoluer en fonction des
conditions de température de séchage et récupérer
leurs formes initiales.
La présence en quantité notable de
différents excipients s'est avérée favorisante de
l'accélération de certaines transformations polymorphiques. On
cite l'exemple du carvédilol et l'aténolol qui sont des
bétabloquants : une fois mélangé au povidone, le
carvédilol passe de la forme II à la forme III [26] alors que
l'aténolol perd sa cristallinité complètement à
cause des fortes interactions entre le principe actif et l'excipient.
En outre, pour d'autres familles de molécules
thérapeutiques, le broyage du chloramphenicol en présence de la
silice colloïdale provoque aussi l'amorphisation de ce dernier [20].
III.3. Conséquences du polymorphisme
III.3.1. Répercussion sur la biodisponibilité et
sur le profil de dissolution
Il est important, pour des considérations de
contrôle de qualité, d'illustrer les différents profils de
dissolution pour une molécule donnée dans le cas de l'existence
d'un polymorphisme. La cinétique de dissolution dépend de la
forme cristalline considérée mais également de
l'état d'agglomération, de la distribution granulométrique
de la surface spécifique et de la réactivité surfacique
[25].
III.3.2. Effets sur les propriétés
physicochimiques
Les molécules à l'état solide
présentent toujours une certaine réactivité
physico-chimique plus faible qu'à l'état liquide ou gazeux.
Néanmoins, dans certains cas, les phases amorphes peuvent
présenter des réactivités très importantes par
rapport à la forme cristallisée caractérisée
généralement par une meilleure stabilité [26].
La cristallisation de composés à
intérêt pharmaceutique est très compliquée car elle
résulte de la compétition de nombreux mécanismes comme la
croissance des différentes formes cristallines et la transformation des
formes métastables vers les formes stables. Pour contrôler le
polymorphisme, il est donc nécessaire de connaître et
INSAT Chapitre I : Etude
bibliographique
â 1 sélectifs

ex : acébutolol, aténolol bétaxolo,
métoprolol...
de comprendre non seulement l'influence des différentes
conditions opératoires mais aussi les divers mécanismes
élémentaires mis en jeux lors de la cristallisation [27].
IV. Principes actifs étudiés
IV.1. Choix des principes actifs
Cette étude est faite sur l'acébutolol, le
bétaxol et le carvédivol qui des principes actifs dont, au moins
trois produits finis, sont commercialisés en Tunisie. Les
médicaments sont sous forme de comprimés (non enrobés et
enrobés, sécables et non sécables). Leurs compositions
diffèrent de point de vue dosage de la substance active et excipients
utilisés pour leurs formulations. Ils sont aussi fabriqués par
des méthodes différentes (compression directe,
granulation...).
IV.2. Classe thérapeutique
Les bétabloquants appartiennent à la classe des
antihypertenseurs qui sont des médicaments très utilisés
en cardiologie ainsi que pour le traitement de pathologies diverses. Ce sont
des antagonistes de récepteurs adrénergiques du système
nerveux autonome sympathique (Figure 4) [28].
Non selectifs
ex : carvédilol, nadolol propranolol, timolol...
Béta-antagonites
|
Antagonistes des récepteurs adrénergiques
|
Non séléctifs
2012-2013 28
|
Alpha-antagonistes
|
á 1sélectifs
|
|
á 2 sélectifs
|
Fig- 4 : Les différentes classes des
antagonistes des récepteurs adrénergiques
INSAT Chapitre I : Etude
bibliographique
2012-2013 29
IV.3. Propriétés
physicochimiques
Les noms IUPAC et les structures des principes actifs
étudiés sont les suivants :
|
Acébutolol (chlorhydrate)
|
|
Nom IUPAC
|
Chlorhydrate de
N-[3-acétyl-4-[(2RS)-2-hydroxy-3-[(1-méthyl)
amino] propoxy)
phényl] butanamide.
|
|
Structure
|
|
|
|
Bétaxolol (chlorhydrate)
|
|
Nom IUPAC
|
Chlorhydrate de (2RS)-1-[4-[2-(cyclopropylmethoxy)
éthyl]phenoxy]-3-[(1-méthyléthyl) amino] propan-2-ol.
|
|
Structure
|
|
|
|
|
|
Carvédilol
|
|
Nom IUPAC
|
[3 - (9H-carbazol-4-yloxy)-2-hydroxypropyl] [2 -
(2-méthoxy phénoxy) éthyl] amine.
|
|
Structure
|
|
|
INSAT Chapitre I : Etude
bibliographique
2012-2013 30
Le tableau (1) résument les propriétés
physicochimiques [@1].
Tableau 1 : Propriétés
physicochimiques des principes actifs étudiés
|
Principe actif
|
|
Propriété
|
Acébutolol
|
Bétaxolol
|
Carvédilol
|
|
Formule chimique
|
C18H28N2O4, HCl
|
C18H29NO3, HCl
|
C24 H26 N2 O4
|
|
Masse molaire (g.mol-1)
|
372,88
|
343,88
|
406,47
|
|
Température de fusion
|
141-143°C
|
113-117 °C
|
114-115 °C
|
|
pKa
|
9,4
|
9,4
|
15
|
|
Réfractivité
|
88,64
|
88.64
|
115.64
|
|
Lipophilie
|
Log P = 0,2
|
Log P = 0,59
|
Log P >1
|
|
Solubilité (eau) (mg.L-1)
|
220
|
451
|
0,583
|
|
Aspect
|
Poudre cristalline
blanche
|
Poudre cristalline
blanche
|
Poudre cristalline
blanche
|
Plusieurs substances actives peuvent se présenter sous
différentes formes polymorphiques.
L'acébutolol existe seulement sous la forme de deux
polymorphes á et â. La forme utilisée pour les formulations
médicamenteuse est celle de á [29].
Pour le cas de carvédilol, plusieurs études ont
fait l'objet de la préparation d'une variété importante de
polymorphes et de pseudopolymorphes afin d'améliorer son comportement
lors de la dissolution : les formes (I), (II) et (IV) sont des anhydres, la
forme (V) est un solvate et la forme (III) est un hydrate [30].
Cependant, jusqu'au aujourd'hui, le bétaxolol n'est
connu que sous une seule forme cristallisée utilisée dans
l'industrie pharmaceutique.
| 


