3. Caractérisation moléculaire des MT et
des sporophores
L'utilisation d'outils moléculaires (PCR -RFLP et
séquencage) s'était avérée indispensable pour
relier, d'une part les MT aux sporophores, et, d'autre part, identifier les
sporophores aux MT.
Ë partir de 170 échantillons d'ECM
collectées au niveau des arbres-mères et de leurs plantules le
long du transect, l'amplification de l'ITS n'a été possible que
pour 145 d'entre eux. Les tailles des régions ITS amplifiées sont
comprises entre 600 et 1183 pb et s'avèrent peu variables pour
discriminer les champignons (Figure 14).
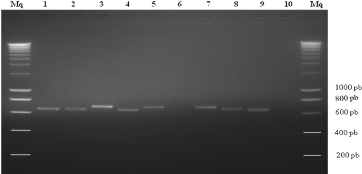
Figure 14. Produits de l'amplification par
PCR de la région ITS de l'ADNr de morphotypes. Puits: 1, 4 et 9= bcf ; 2
et 8= bff; 3= bbl ; 5= bcc; 6= pas d'amplifiat ; 7= bp; 10= témoin
négatif; Mq, marqueur de poids moléculaire (1kb).
Parmi les enzymes de restriction préalablement
testées (TaqI, HaeIII et HinfI), l'enzyme
Hinf I a été retenue parce qu'elle a
généré plus de bandes de restriction (résultats non
montrés). La digestion des amplifiats des différents MT par
HinfI a généré entre un et trois fragments de
restriction de tailles différentes (Figure 15). On a ainsi
caractérisé 6 ribotypes (A, B, C, D, E et F) pour 9 MT
décrits (Tableau 5). La diversité des MT ne correspond donc pas
à celle des ribotypes.
Parmi les 6 ribotypes, 4 (A, B, C et D) ont
présenté des profils RFLP identiques aux 4 espèces de
sporophores récoltées. Les ribotypes A, B, C et D correspondent
respectivement à S. bermudense, R. cremeolilacina,
C. cinnabarinus et I. xerophytica. L'identification
moléculaire, basée sur la comparaison des profils RFLP, a
été confirmée par le séquençage de l'ITS des
mêmes échantillons. Par contre, les ribotypes E et F n'ont pas
été reliés aux sporophores. Ces deux ribotypes ont
été, cependant, identifiés à deux espèces
de Tomentella par séquençage de l'ITS. Ce
résultat n'est pas surprenant car on sait par ailleurs que les
Tomentella fructifient rarement (Diédhiou et al., 2004).
On n'a pas trouvé de MT correspondant aux champignons I.
littoralis et A. arenicola dont les sporophores ont
été pourtant récoltés le long du gradient. Il est
possible que ces deux champignons aient formé très peu d'ECM. Il
existe en effet des champignons comme Suillus qui fructifient
abondamment mais forment très peu d'ECM (Smith & Read, 2008).
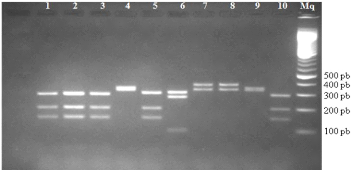
Figure 15. Produits de digestion par
HinfI de la région ITS de l'ADNr des morphotypes. Puits : 1, 2,
3, 5 et 10= ribotype E ; 4 et 9= ribotype F ; 6= ribotype A ; 7 et 8= ribotype
D ; Mq, marqueur de poids moléculaire (100 pb).
Il appara»t que les MT bcc, bp et bcf correspondent
à un mélange de ribotypes. Par exemple, le MT bp est un
mélange de 4 ribotypes. Ë l'inverse, un même ribotype peut
correspondre à des MT différents. C'est le cas notamment du
ribotype B trouvé chez 4 MT (bcc, mgcs, jpf et bp). En revanche, les MT
bbl et jpp ont été, dans tous les cas, rattachés
respectivement au ribotype A de S. bermudense et au ribotype C de
C. cinnabarinus. Cette étude montre les limites du morphotypage
pour identifier sans ambigu
·té la composante fongique des ECM
et pour évaluer la fréquence des champignons observés sur
les racines. Il est en effet bien connu que la couleur du manteau fongique peut
changer en fonction de l'âge des MT, de la plante hTMte et de
l'environnement (Diédhiou et al., 2004 ; Pestana Nieto &
Santolamazza Carbone, 2009 ; Diédhiou et al., 2009). Le cas
des
Tomentella est bien documenté à ce
propos. Ces champ ignons ont la particularité de former des MT brun
clair qui deviennent brun foncé au cours du vieillissement des racines
de la plante hôte (B%o et al., 1991 ; Diédhiou
et al., 2004).
Tableau 5. Polymorphisme de longueur des
fragments de restriction de la région ITS (digestion par HinfI)
des sporophores et des morphotypes ectomycorhiziens d'arbres-mères et de
plantules de Coccoloba uvifera. (*) E= Tomentella sp2 ; F=
Tomentella sp1.
|
Morphotype/ Sporophore
|
Taille
de l'I TS (pb)
|
Taille des fragments de restriction de l'ITS
(pb)
|
Ribotype
|
|
bbl
|
689
|
100, 270, 311
|
A
|
|
bcc
|
689
|
100, 270, 311
|
A
|
|
bcc
|
718
|
313, 392
|
B
|
|
bcc
|
738
|
346, 392
|
D
|
|
mcgs
|
718
|
315, 392
|
B
|
|
jpf
|
718
|
315, 392
|
B
|
|
jpp
|
1183
|
217, 433, 533
|
C
|
|
bp
|
689
|
100, 270, 311
|
A
|
|
bp
|
718
|
315, 392
|
B
|
|
bp
|
738
|
346, 392
|
D
|
|
bp
|
633
|
346
|
E*
|
|
bcf
|
633
|
346
|
E
|
|
bcf
|
655
|
165, 211, 308
|
F*
|
|
bfp
|
633
|
346
|
E
|
|
bff
|
655
|
165, 211, 308
|
F
|
|
S. bermudense
|
689
|
100, 270, 311
|
A
|
|
R. cremeolilacina
|
718
|
313, 392
|
B
|
|
C. cinnabarinus
|
1183
|
217, 433, 533
|
C
|
|
I. xerophytica
|
738
|
346, 392
|
D
|
|
I. littoralis
|
700
|
300, 400
|
G
|
|
A. arenicola
|
600
|
300
|
H
|
Le calcul de la fréquence des MT (Figures 12 et 13)
reste approximatif pour certains MT (bcc, bp et bcf) constitués
dÕun mélange de ribotypes. CÕest pourquoi il nous a paru
intéressant dÕévaluer la fréquence de 6 ribotypes
(Figure 16 et 17) pour avoir une estimation plus précise des
différents champignons sur les racines. Les fréquences des
ribotypes A, E et F sont globalement supérieures à celles des
ribotypes B, C et D quel que soit le stade de développement de
Coccoloba (Figure 16). Ces résultats sont en accord avec les
fréquences des MT (Figure 13). S. bermudense,
Tomentella sp1 et Tomentella sp2 sont majoritairement
presents sur les racines des arbres-mères et leurs plantules en milieu
peu salé. Ces trois champignons pourraient constituer des réseaux
ectomycorhiziens potentiels reliant les arbres-mères et leurs
plantules.
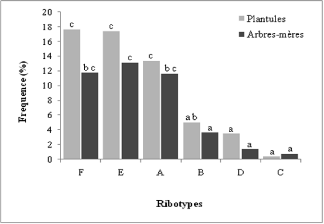
Figure 16. Frequence des six ribotypes (F, E, A,
B, D et C) des arbres-meres et de leurs plantules en milieu peu sale.
En milieu sale, il y a moins de ribotypes quÕen milieu
peu sale. Le ribotype A, rattaché à S. bermudense, a
été plus frequent que les ribotypes F et B rattachés
respectivement à Tomentella sp1 et R. cremeolilacina
(Figure 17). On a vu aussi que parmi les 3 ribotypes, seul S.
bermudense avait fructifié en milieu sale. Le cycle de reproduction
sexuée de ce champignon serait adapté à la
salinité.
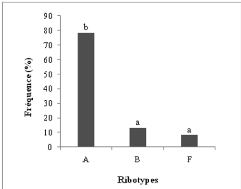
Figure 17. Fréquence de trois ribotypes
(A, B et F) des arbres en milieu salé.
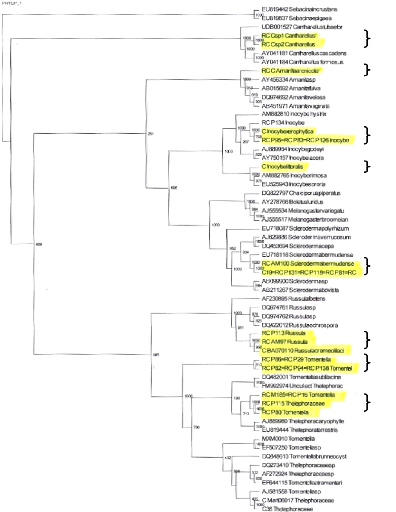
Nous avons confirmé, au moins au niveau du genre,
l'identification morphologique des sporophores et identifié la
composante fongique des MT par le séquençage des régions
ITS de l'ADNr nucléaire (Figure 18). L'analyse des séquences de
l'ITS nous a permis aussi de confirmer l'analyse RFLP et de relier des MT aux
sporophores. Sur l'arbre phylogénétique, on a distingué 8
groupes fongiques: C. cinnab arinus, A. arenicola, I. xerophytica, I.
littoralis, S. bermudense, R. cremeolilacina, Tomentella sp1 et
Tomentella sp2. Parmi les huit groupes, deux (A. arenicola et
I. littoralis) ne présentent pas de MT, quatre (C.
cinnabarinus, I. xerophytica, S. bermudense et R. cremeolilacina)
sont reliés à des MT, et deux (Tomentella sp1 et
Tomentella sp2) ne présentent pas de sporophores. Il y a une
forte homologie entre les séquences de chaque groupe
phylogénétique. Par exemple, les séquences des MT (AM100,
P131, P118 et P81) montrent une forte homologie (100%) avec la séquence
du sporophore (C19) de S. bermudense (Figure 18). Tout compte fait, la
diversité des sporophores ne reflète pas la diversité des
MT comme c'est le cas dans la plupart des régions tropicales
(Rivière et al., 2007 ; Sanon et al., 2009 ;
Diédhiou et al., 2009). La composition physico-chimique du sol
étant relativement homogène le long du gradient, il est fort
probable que la salinité participe en partie à la structuration
des communautés de champignons ectomycorhiziens de C. uvifera.
En effet, sur 8 groupes de champignons inventoriés, seules 3
espèces (S. bermudense, Tomentella sp1 et R.
cremelilacina) ont été présentes à
proximité du bord de mer et pourraient contribuer à l'adaptation
de Coccoloba à la salinité. Yamato et al.
(2008) ont montré à cet égard le rTMle important des
MA dans la structuration des herbacées et des plantes rampantes en
bordure de mer.
I
II
V
VI
VII
VIII
III
IV
Figure 18. Arbre phylogénétique
basé sur le séquencage de l'ITS des huit taxons fongiques (I
à VIII surlignés en jaune) de C. uvifera, comparé
à des séquences de référence dans GenBank (en
noir). Les valeurs de Ç bootstrap È sont indiquées au
niveau des branches.
|
|



