Chapitre I
Etude bibliographique relative aux
couches minces de ZnO et les
techniques de dépôt
I-1. Propriétés physiques de l'oxyde de
zinc
Les principales propriétés physiques de l'oxyde de
zinc de structure hexagonale [1] sont regroupées dans le tableau 1.
Tableau 1 :
Propriétés physiques de l'oxyde de zinc à structure
hexagonale.
|
Propriété
|
Valeur
|
|
Paramètres de maille à 300 K :
a
0
c
0
c/a
00
|
0,32495 nm
0,52069 nm
1,602 (1,633 pour la structure
hexagonale
idéale)
|
|
Masse volumique
|
5,606 g cm-3
|
|
Phase stable à 300 K
|
wurtzite
|
|
Point de fusion
|
1975°C
|
|
Conductivité thermique
|
1-1,2 W m-1 K-1
|
|
Coefficient d'expansion linéaire (/°C)
|
-6-6
a: 6,5 10, c: 3,0 10
0 0
|
|
Permittivité relative
|
8,656
|
|
Indice de réfraction
|
2,008-2,029
|
|
Energie de la bande interdite (gap)
|
3,4 eV (direct)
|
|
Concentration de porteurs intrinsèques
|
< 106 cm-3
|
|
Energie de liaison des excitons
|
60 meV
|
|
Masse effective de l'électron
|
0,24
|
|
Mobilité Hall de l'électron à 300 K pour
une
conductivité de type n faible
|
2 -1 -1
200 cmVs
|
|
Masse effective du trou
|
0,59
|
|
Mobilité Hall du trou à 300 K pour une
conductivité
de type p faible
|
2 -1 -1
5 - 50 cmVs
|
I.1.1. Propriétés cristallographiques de
ZnO
Les semi-conducteurs II-VI cristallisent dans la structure
zinc blende ou wurtzite. Ces deux types de structure sont formés de
l'empilement de plans d'anions et de cations successifs de maille hexagonale.
Cette structure permet des liaisons sp3 de symétrie
tétraédrique caractéristiques des liaisons covalentes des
semi-conducteurs. Les semi-conducteurs II-VI sont formés d'anions
A2-(A=O, S, Se, Te) et de cations B2+ (B=Zn, Cd,
Hg). Les composés ZnA et CdA sont semi-conducteurs. On limitera
l'étude aux composés à base de ZnO.
On connaît actuellement trois phases cristallographiques
différentes pour l'oxyde de zinc (figure I.1) : la phase B4 (Wurtzite),
la phase B3 (Blende) et la phase B1 (Rocksalt). La structure Wurtzite
(hexagonale) est la structure thermodynamiquement stable à
température ambiante. La structure Blende (cubique) est observée
lorsque ZnO est déposé sur certains substrats de symétrie
cubique, La structure Rocksalt (NaCl) est obtenue lorsqu'une pression
hydrostatique (10-15 GPa) est appliquée sur la structure Wurtzite. Cette
dernière est une phase métastable qui peut persister à
pression atmosphérique.
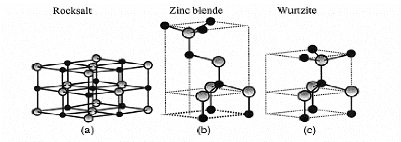
Figure I.1 : Représentation des structures
de ZnO : (a) cubique rocksalt, (b) cubique zinc blende et
(c) hexagonal
wurtzite.
La phase wurtzite (WZ) se distingue de la phase blende de
zinc(ZB) seulement par la séquence d'empilement des couches d'atomes.
Les plans hexagonaux s'empilent suivant la séquence ABCABC selon [111]
en phase ZB (figure I.2(c)) et suivant la séquence ABAB selon [0001] en
phase WZ (figure I.2(d)).
La structure blende de zinc appartient au groupe d'espace F43m
(Td) et correspond à deux sous-réseaux cubiques à face
centrées formées respectivement des atomes de la colonne III et V
décalés l'un de l'autre du quart d'une diagonale du cube. Le
paramètre de maille a correspond à la longueur d'une arête
du cube.
La structure wurtzite appartient au groupe d'espace P63mc
(C46v) et correspond à deux sousréseaux
hexagonaux compacts composés d'atomes de chacune des deux colonnes
(III-V ou II-VI) décalés de 3/8c, c et a étant les
paramètres de maille (figure I.2(b)). Ils forment un empilement de type
ABAB selon l'axe [0001] aussi appelé axe c de la structure wurtzite.
Dans cette thèse nous nous intéresserons uniquement à la
structure de type Wurtzite.
Le tableau (2) illustre la différence entre ces deux
structures.
Tableau 2: Comparaison entre les
propriétés des deux structures de ZnO.
|
Structure wurtzite
|
Structure cubique
|
|
Paramètre de réseau (A)
|
a=3.24
c=5.20
|
a=4.28
|
|
Coordination (Z)
|
2
|
4
|
|
Densité (g/cm3)
|
5.6
|
6.9
|
|
Groupe spatial
|
P63mc
|
Fm3m
|
|
Condition d'apparition (kbar)
|
Pression atmosphérique
|
Haute pression p=100
|
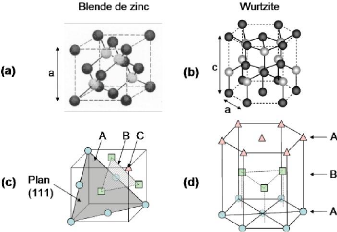
Figure I.2 : Représentation
schématique de la structure cristaiographique (a) blende de zinc et
(b)
wurtzite. Les séquences d'empilement de couches atomiques sont
mises en évidence en (c) et (d) :
ABCABC en blende de zinc et ABAB en
wurtzite.
L'oxyde de zinc cristallise dans les conditions normales suivant
une structure de type wurtzite, donnée par la figure I.2.b.
La maille hexagonale de la structure Wurtzite se
caractérise par trois constantes de réseau a, c et u ; a
étant le côté d'un losange constituant la base, c le
côté parallèle à l'axe oz et u est une
coordonnée intérieure le long de cet axe. Ces constantes
déterminent la position relative des sous-réseaux de l'anion
O2 et du cation Zn2+. La
coordonnée u est définie par la relation suivante :
2
1 c
2
u = +
4 3a
D'après cette relation, on remarque que le
paramètre u est sans dimension. La distance séparant les plans
réticulaires d'indices (h,k,l) est donnée par la relation :
1 4 2 2
= 2 ( h hk k
+ + )
dhkl a
2 3
l 2
+
c 2
La condition de stabilité de cette structure est
donnée par la relation suivante :
R
0,225 = a =0,4 1 4
Rc
où Ra et Rc
désignent respectivement le rayon de l'anion et celui du cation.
L'origine de cette condition provient des considérations suivantes :
¾ pour une structure hexagonale compacte (H.C.), on a :
3
R a R c 8 c
+ =
Avec
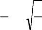
c
=
a
2
3
2
Et
2Ra < a
¾ Comme la structure H.C dérive de la structure
cubique à face centré (C.F.C.) de la
blende, on a aussi
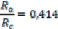
Dans le tableau 3, on présente un récapitulatif
des caractéristiques importantes de l'oxyde de zinc. D'après les
valeurs des rayons ioniques du cation et de l'anion indiquées dans le
tableau, on peut remarquer que la structure est relativement ouverte. En effet,
les atomes de zinc et d'oxygène n'occupent que 40 % du volume du cristal
[2], laissant des espaces vides de rayon 0,95 Å. Il est possible que,
dans certaines conditions, des atomes de zinc en excès
puissent se loger dans ces espaces c'est-à-dire en
position interstitielle. Cette caractéristique permet d'expliquer
certaines propriétés particulières de l'oxyde,
liées aux phénomènes de semi-conductivité, de
photoconductivité, de luminescence, ainsi qu'aux
propriétés catalytiques et chimiques du solide [3].
Tableau. 3 : Récapitulatif des
caractéristiques de la structure cristalline du ZnO
|
Réseau
|
Hexagonal Wurtzite
|
|
Paramètres de maille
|
a =
|
3,2499 A = 1,6019 5,2060 A
|
|
c/a
|
|
c =
|
|
Distance entre O2- et
Zn2+, (les plus proches
voisins)
|
Suivant l'axe c d = 1,96 A
Pour les trois autres d = 1,98 A
|
|
Rayon ionique pour
une
coordination
tétraédrique
|
Liaison covalente
Liaison ionique
|
Zn neutre = 1,31 A
Zn2+ = 0,60
A
Zn2+ : 0,70 A
Zn2+ : 0,78 A
Zn2+ :
0,60 A
|
O neutre = 0,66 A
O2- = 1,38
A
O2- : 1,32 A (Pauling) [4]
O2- : 1,24 A
(Goldsmith)[5]
O2- : 1,38 A (Shannon) [6]
|
|
Rayon cristallin pour une
coordination
tétraédrique
|
Zn2+= 0,74 A
O2 = 1,24
A
|
| 


