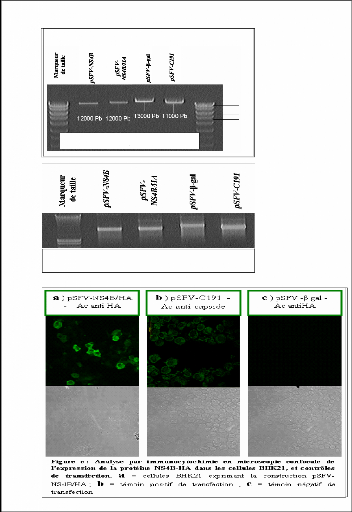
D- Expression de la protéine NS4B
a. Immunofluorescence des cellules BHK-21
transfectées
Vingt heures post transfection, les cellules BHK-21 ont
été trypsinées, lavées au PBS, comptées et
reprises dans du PBS contenant 10% de sérum de veau foetal, à
raison de 2,5.105 cellules/mL. Cent microlitres de cette suspension
cellulaire ont été déposés dans une cupule et
cytocentrifugés sur des lames (Cytospin 3, Shandon) pendant 5 minutes
à 250 g. Après séchage et fixation, les lames ont
été fixées dans un bain d'acétone à
-20°C pendant 10 minutes, les cellules transfectées avec les
constructions pSFV-NS4B, -NS4B/HA et SFV-âgal, ont été
incubées en chambre humide pendant 30 min avec 40 j.iL d'un anticorps
monoclonal de rat anti-HA (Sigma) dilué au 1/250e en PBS. Les cellules
transfectées avec la construction pSFV-C191 ont été
incubées avec un anticorps monoclonal murin anti-capside (C7-50, Abcam)
dilué au 1/200e en PBS. Après trois lavages de 10 min
dans du PBS, les cellules ont été incubées comme
précédemment avec 40 j.iL d'un anticorps secondaire de
chèvre anti-rat ou chèvre anti-souris conjugué à
l'Alexa Fluor 488 (molecular Probes®) dilué au
1/1000e. Après trois nouveaux lavages, les lames ont
été montées en milieu PVA/DABCO (25 mM Tris/HCl 1.5M [pH
8.8],
glycérol 5%, DABCO 2,5%, alcool polyvinylique (PVA) 10%),
puis observées au microscope confocal à balayage (Microscope
Confocal à Balayage Laser, Olympus).
b. Western-blot des lysats des cellules BHK-21
transfectées
Après transfection, les cellules BHK-2 1 ont
été trypsinées, lavées au PBS, et lysées
avec 1 mL de tampon de lyse (Tris/HCl 10 mM, NaCl 140 mM, igépal 1%)
supplémenté avec des inhibiteurs de protéases
(phénylméthylsulfonyl fluoride (PMSF) 1mM, aprotinine et
leupeptine 2 ìg/mL). Vingt microgrammes de protéines contenues
dans les lysats cellulaires ont été précipitées et
soumises à une électrophorèse en gel d'acrylamide 12%
(Euromedex) pendant 1h30 à 20 mA (Mini Protean III, BioRad), suivies
d'un transfert actif (Mini Trans-Blot Cell, BioRad) en tampon
TG/éthanol(Tris 0.25M, Glycine 1 .92M, éthanol 20%) sur une
membrane de nitrocellulose (Hybond-C Extra, Amersham Biosciences) durant 1h30
à 90V. Cette membrane a ensuite été saturée pendant
45 minutes en tampon TBS (Tris-HCl 50 mM [pH8] NaCl 150mM, igépal 0.1%)
contenant 5% de lait en poudre. Ensuite, la membrane a été
incubée en présence d'un anticorps monoclonal de rat anti-HA ou
de souris anti-actine (AC-15, Sigma) dilués au 1/5000e ou
d'un anticorps monoclonal humain anti-capside (B12F8, fourni par le Dr
Mondelli, Université de Rome, Italie) dilué au
1/2000e, pendant un nuit à 4°C. Après 3 lavages
de 10 minutes en tampon TBS, la membrane a été incubée
durant une heure, à température ambiante et sous agitation douce,
avec un anticorps secondaire couplé à la peroxydase (anti-rat,
-souris et -humain, Biosource) dilués au 1/10 000e en tampon
de blocage. Enfin, après 2 lavages de 10 minutes et un lavage de 20
minutes en tampon TBS, la révélation a été
réalisée avec un système de détection
chimioluminescent ECL (Pierce) et le signal a été
transféré sur un film d'autoradiographie (Pierce).
c. Microscopie électronique des cellules BHK-21
transfectées
Un tapis cellulaire d'une flasque T75 de cellules BHK-2 1
transfectées a été directement fixé dans la flasque
par ajout de 5 ml d'un tampon tampon phosphate 0,1 M [pH 7.2] (Sigma) contenant
4% de paraformaldéhyde et 1% de glutaraldéhyde, et les cellules
ont ainsi été incubées pendant 48 heures à
4°C. Après un rinçage en tampon phosphate 0,15 M, les
cellules ont été post- fixées à l'aide de
tétroxyde d'osmium 1% en tampon phosphate 0,3 M pendant 1 heure, avant
d'être déshydratées par trempage dans des bains
d'éthanol de titres croissants. Après un lavage dans l'oxyde de
propylène, les cellules ont été incluses dans un
mélange oxyde de propylènerésine/Epon, et incubées
24 heures à 60°C pour permettre la polymérisation de la
résine. Les coupes ultra-fines de blocs ont été
réalisées à l'aide d'un ultramicrotome (Reichert
Scientific Instruments), et contrastées à l'acétate
d'uranyl et au citrate de plomb, avant d'être observées en
microscopie électronique à transmission (MET) (Jeol 1230,
Jeol).
Marqueur de taille
(Pb)
10 000
8 000
6 000
5 000
4 000
Figure a. Migration électrophorétique sur
gel d'agarose (1%BET)
des vecteurs d'expression
linéarisés
Figure b : Migration électrophorétique sur gel
d'agarose 1% (+BET) des vecteurs d'expression transcrits
| 


