2-2-12- Observation des lames après coloration
- Observer les lames sous microscope optique
et traiter les captures avec le logiciel installé. Après avoir
choisi les lames à colorer, elles sont ensuite observées et
étudiées par la station cytogénétique
motorisée relié à un ordinateur traitant les images par le
logiciel : Cytovision®. On observe premièrement avec
l'objectif (x10) puis, lorsqu'on repère une bonne mitose, on met une
goutte d'huile d'immersion et on passe à l'objectif (x63) et
après à l'objectif (x100).
2-2-13- L'interprétation des résultats
- La lecture des résultats et la
prononciation sur la présence d'une éventuelle anomalie se fait
par comparaison avec un caryotype de référence normal
(figures 07 et 08).
58
Patients et méthodes
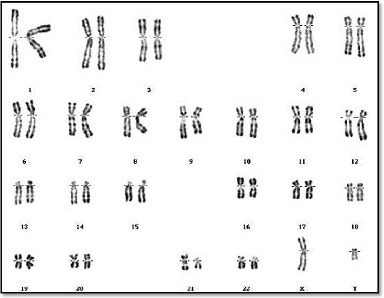
Figure 07 : Caryotype normal d'un individu de
sexe masculin (46,XY) (RHG)
(Huret et al., 2003)
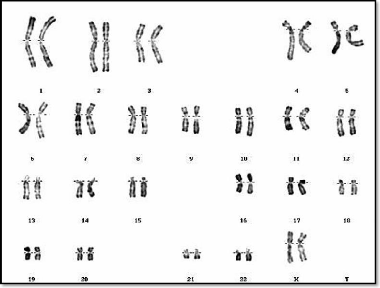
Figure 08 : Caryotype normal d'un individu de
sexe féminin (46,XX) (RHG)
(Huret et al., 2003).

59
Résultats et discussion
Dans notre travail de recherche, nous avons essayé de
réaliser une enquête épidémiologique descriptive,
prospective concernant les fausses couches spontanées à
répétition dans la région de Constantine. Plusieurs
raisons nous ont amené à porter la réflexion de ce sujet.
En effet, les fausses couches qui correspondent à des pertes
spontanées et consécutives de grossesses sont devenues un
phénomène traumatisant et assez courant dans la population
générale soit pour les grossesses cliniquement reconnues ou les
grossesses qui échouent avant d'être reconnues, ainsi
l'étiologie de la FCSR est souvent inconnue et il existe peu de
stratégies de diagnostic et de traitement fondées sur des
preuves. Les études épidémiologiques de ces
dysfonctionnements sont importantes pour comprendre le trouble et son
apparition dans la population et pour également identifier les facteurs
de risques.
Dans notre objectif de départ, nous nous sommes
engagé à suivre une démarche de recherche d'une
étiologie et l'identification des facteurs à l'origine des pertes
récurrentes grâce à l'utilisation des données
clinico-biologiques et du matériel génétique des parents
recrutés au niveau du CHU Benbadis et de la maternité Sidi
Mabrouk - Constantine pour la réalisation des caryotypes et les
différentes techniques cytogénétiques.
Pour l'enquête épidémiologique, nous avons
préparé un questionnaire visant à recueillir les
données cliniques et biologiques des femmes enrôlées dans
notre cohorte d'étude. Durant la période de notre stage qui a
commencé en février 2020, nous avons collecté 14
échantillons qui correspondent à des prélèvements
sanguins pour 7 couples ayant vécu des ASR, dont l'âge des
conjointes varie entre 32 ans et 39 ans. Ces échantillons ont
été mis en culture et traités afin de réaliser les
caryotypes et identifier les anomalies chromosomiques. Malheureusement, il a
été impossible de les réaliser et de traiter les
échantillons restants suite à l'apparition et à la
propagation de la pandémie du COVID-19 qui forçait l'arrêt
du travail. La mise en place de l'enquête épidémiologique
était aussi impossible pour la même raison. Malheureusement,
l'analyse cytogénétique en bande R n'a été
complétée que pour quatre couples. Sur ces quatre couples, le
conjoint présente un syndrome de Klinefelter typique (47,XXY) (figures
17 et 18). Pour les autres, les caryotypes étaient euploïdes :
aucune anomalie chromosomique de nombre ou de structure n'a été
relevée (figures 09, 10, 11, 12, 13, 14, 15, 16, 19, 20, 21 et 22).
Résultats et discussion
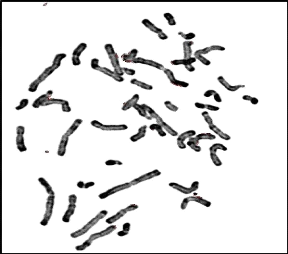
Figure 09 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement 100×) (Couple 01 : Conjoint).
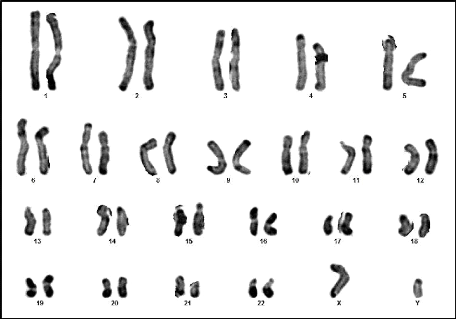
Figure 10 : Caryotype (46,XY) (RHG) (Couple 01
: Conjoint).
60
61
Résultats et discussion
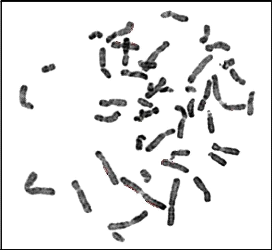
Figure 11 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé (Grossissement
100×) (Couple 01 : Conjointe).
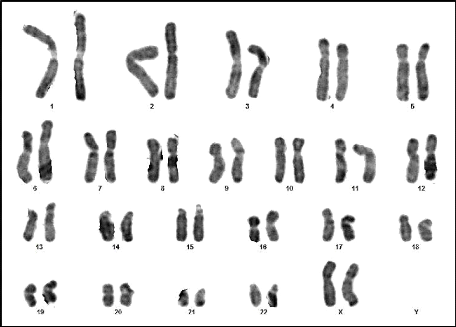
Figure 12 : Caryotype (46,XY) (RHG) (Couple 01
: Conjointe).
Résultats et discussion

Figure 13 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement
100×) (Couple 02 : Conjoint).
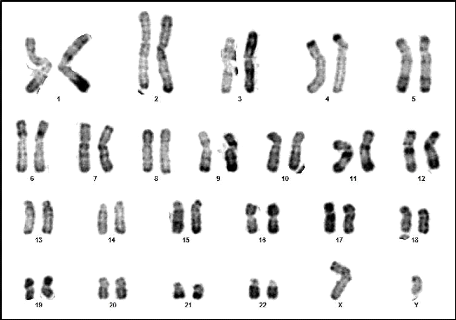
Figure 14 : Caryotype (46,XY) (RHG) (Couple 02
: Conjoint).
62
Résultats et discussion

Figure 15 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement
100×) (Couple 02 : Conjointe).
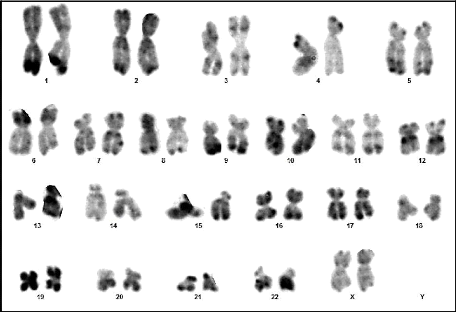
Figure 16 : Caryotype (46,XX) (RHG) (Couple 02 :
Conjointe)
63
Résultats et discussion

Figure 17 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement 100×) (Couple 03 : Conjoint).
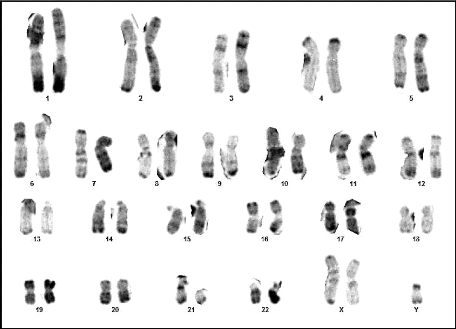
64
Figure 18 : Caryotype (47,XXY) (RHG) (Couple 03
: Conjoint)
Résultats et discussion

Figure 19 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement 100×) (Couple 04 : Conjoint).
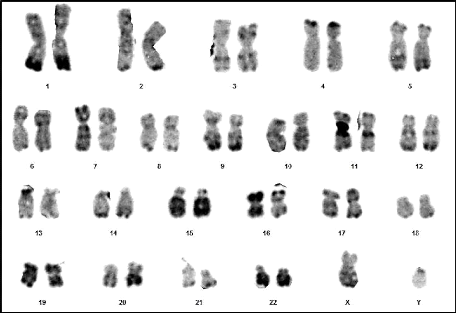
Figure 20 : Caryotype (46,XY) (RHG) (Couple 04
: Conjoint).
65
Résultats et discussion

Figure 21 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement 100×) (Couple 04 : Conjointe).
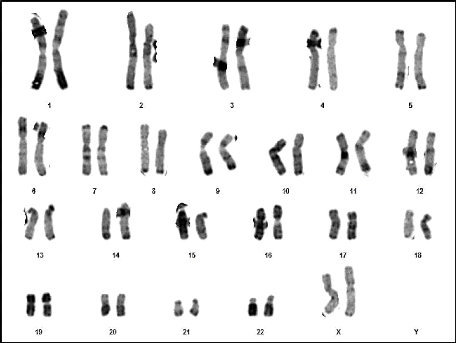
66
Figure 22 : Caryotype (46,XX) (RHG) (Couple 04 :
Conjointe).
67
Résultats et discussion
La reproduction humaine est un processus très frustrant
où 70% des conceptions humaines ne parviennent pas à atteindre la
viabilité, et environ 50% de toutes les grossesses sont perdues avant
les menstruations attendues (McCoy et al., 2015). Les ASR sont des
complications de la reproduction qui affectent 1 à 5% des couples qui
essayent d'avoir un enfant et environ 15 à 20% des grossesses
diagnostiquées (Lejeune 2006).
Dans une étude longitudinale, Regan et al,
suivaient 630 femmes de la population générale ayant l'intention
de tomber enceinte. Dès qu'une grossesse a été
suspectée ou que des symptômes d'avortement menaçants ont
été observés, des études échographiques en
série ont été réalisées pour documenter la
viabilité ou la perte. Parmi les 412 grossesses cliniquement reconnues,
il y a eu 357 grossesses réussies, 50 ont vécu des fausses
couches spontanées 2 grossesses ectopiques et 3 avortement induits.
À l'exclusion des grossesses extra-utérines et des avortements
provoqués, l'occurrence globale des fausses couches spontanées
reconnues était de 12% ce qui correspond précisément
à la fréquence fixée par Wilcox et al (Regan
et al., 1989).
Lorsque d'autres études ont montré une
prévalence plus élevée de la perte de grossesse, allant de
10 à 15%, une étude basée sur une population a
montré que 13,5% des grossesses à terme se sont terminées
par une perte foetale (Nybo Andersen et al., 2000). Il a
été montré que les ASR affectent environ 1% à 2%
des femmes, lorsqu'on parle de trois pertes consécutives de grossesses
avant 20 semaines de la dernière période menstruelle (Ford et
Schust, 2009). Larsen a signalé une prévalence de 0,8% à
1,4% si seulement les pertes cliniques sont inclues, lorsqu'on prend en
considération les pertes biochimiques, la prévalence augmente
entre 2 à 3% (Larsen et al., 2013). Si nous parlons de la FCSR
comme deux pertes consécutives avant 20 semaines de la dernière
période menstruelle, elle survient chez 1% à 3% de tous les
couples qui tentent de concevoir (Eshre, 2017).
Dans les études prospectives, le risque de perte de
grossesse augmente avec chaque perte d'environ 11% chez les nulligravides
à environ 40% après trois pertes ou plus (Magnus et al.,
2019). Les facteurs de risque connus de FCSR sont l'âge de la femme, les
pertes de grossesse antérieures, les anomalies chromosomiques
structurelles parentales, les anomalies utérines, les troubles
endocriniens, le syndrome des anti-phospholipides (APS) et la thrombophilie
héréditaire. L'âge avancé de la mère a
été considéré comme lié à la
réduction de la qualité et de la quantité des ovocytes
restants. Selon une vaste étude prospective sur ce constat, le risque de
fausse couche lié à l'âge dans les grossesses reconnues a
été évalué comme étant de : 13% en 12-19
ans, 11% en 20-24 ans, 12% en 25-29 ans, 15% en 30-34 ans, 25% en 35-39 ans,
51% en 40-44 ans, 93% en 45 ans (Rohilla et al., 2017).
68
Résultats et discussion
Même après des enquêtes approfondies, une
cause d'ASR est identifiée dans moins de 50% des couples (Alijotas et
Gimenez, 2013). Par conséquent, la majorité des cas restent sans
facteur de risque connu. Seuls l'âge de la femme et le nombre de fausses
couches antérieures se sont révélés être des
facteurs pronostiques pour la majorité des patientes (Eshre, 2017). En
dehors des fausses couches idiopathiques, les anomalies chromosomiques
représentent la cause la plus fréquente de FCS sporadique, et
elles sont retrouvées dans 50 à 70% des FCS du premier trimestre.
Elles sont mises en évidence par culture puis caryotype du trophoblaste
de la grossesse arrêtée. Néanmoins, cette technique reste
difficile avec un taux d'échec de culture important de 10 à 40%
(Lejeune, 2006). Par ailleurs, devant la répétition des FCS chez
un couple, la recherche de pathologies génétiques peut permettre
d'expliquer certains de ces accidents.
Des études cytogénétiques
réalisées en l'an 2000, ont monté que la plupart de ces
anomalies sont des anomalies chromosomiques numériques ou
aneuploïdies (86%), et une minorité des cas est causée par
des anomalies chromosomiques structurales (6%) ou mosaïcisme chromosomique
(8%) (Goddijn, 2000).
Dans une série de 422 caryotypes sur trophoblaste chez
des couples ayant fait auparavant au moins trois FCS, Stephenson et
al, retrouvent 54% d'anomalies chromosomiques dont 96% d'anomalies de
nombre (66,5% de trisomies, 10% de polyploïdies et triploïdies, 9% de
monosomies X et 0,5% d'association entre la trisomie 21 et la monosomie du
chromosome X) et 4% d'anomalies de structure (translocations
déséquilibrées) (Stephenson et al., 2002).
Ogasawara et al qui ont analysé les caryotypes
de 1284 couples, ont suggéré que la présence des
aberrations de caryotype parental définissent un groupe de risque
élevé de fausses couches, puisqu'entre 61% et 72% de leurs
patients ont eu des fausses couches ultérieures. La translocation
réciproque était l'anomalie la plus fréquente dans une
étude menée en 2012 sur 168 couples tunisiens : 6 couples sur
168, soit 40% des anomalies (Ogasawara et al., 2004).
Dans la majorité des cas, il n'y a pas de pertes
décelables de matériels chromosomiques, la translocation est
équilibrée et le phénotype est souvent normal, comme chez
les six patients porteurs de cette aberration chromosomique ; c'est ainsi que
la translocation est méconnue et sa révélation se fait par
la survenue d'accidents abortifs (Frikha et al., 2012).
69
Résultats et discussion
Les translocations ont également dominé toutes
les autres anomalies chromosomiques observées sur une population de 137
cas en Chine, la fréquence était de seulement 0,18% des patients
ayant des anomalies chromosomiques de structure parmi les 137 cas
étudié (Dong, 2014). En ce qui concerne l'étude de
Carp et al, sur 916 patients , 99 avaient des aberrations
chromosomiques (10,8%), 817 n'avaient aucune anomalie. parmi les 99 atteints :
68 des femmes ont vécu entre 3-4 fausses couches et 31 ont vécu
plus de 5 avortements. En ce qui concerne les anomalies détectées
: 31 avaient des translocations maternelles équilibrées et 21
avec des translocations équilibrées paternelles, 18
présentaient des mosaïques maternelles et 3 des mosaïques
paternelles, 6 autres patientes, 19 conjoints et un seul couple avaient des
inversions (Carp, 2004). Les inversions chromosomiques sont la seconde anomalie
fréquente chez les couples avec ASR. Dans une série de 51 couples
qui ont vécu des ASR, 7 patient parmi les 51 (13,7%) étaient
porteurs des anomalies de type inversion. (Stephenson, 2002).
Lors d'une étude de Demirhan en 2008, sur une
population de 157 patients porteurs d'inversions péricentriques du
chromosome 9, le taux abortif était significativement
élevé, de l'ordre de 31%. Cela suggère la
susceptibilité d'un locus situé au niveau du point de cassure
pour les phénotypes anormaux qui finissent dans le produit d'avortement.
(Demirhan, 2008). En effet, la région péri-centromérique
(p11q13) est celle impliquée dans ce déséquilibre
chromosomique. Elle est caractérisée par sa richesse en
hétérochromatine constitutive. Cette dernière est
caractérisée par son polymorphisme due au fait de
l'instabilité de l'ADN satellite, formé de courtes
séquences répétées en tandem en un très
grand nombre de fois. Cela rend l'hétérochromatine
transcriptionnellement inactive, ne participant pas à la recombinaison
génétique. On s'est longtemps demandé si
l'hétérochromatine avait un rôle précis dans le
génome humain car son polymorphisme important ne semblait pas avoir de
conséquence fonctionnelle ou phénotypique. Toutefois, elle serait
impliquée dans différents processus génétiques. En
dépit du contrôle de la fonction centromérique lors de la
ségrégation méiotique, l'hétérochromatine
intervient dans l'organisation des domaines nucléaires à la
périphérie ainsi qu'au contrôle
épigénétique. Plus spécifiquement, elle intervient
dans le contrôle de la transcriptabilité du génome. Ainsi,
des gènes habituellement localisés dans l'euchromatine peuvent
être réduits au silence lorsqu'ils sont placés à
proximité d'un domaine hétéro-chromatique. Cela pourrait
aboutir à l'extinction de gènes essentiels intervenant dans la
gamétogenèse, ce qui explique la récurrence des accidents
abortifs chez le couple portant l'inversion péricentrique du chromosome
9 (Frikha et al, 2012).
70
Résultats et discussion
D'autres anomalies chromosomiques de structure peuvent
être trouvées chez les patients présentant des ASR, parmi
lesquels les insertions et les réarrangements chromosomiques.
Dans une série de 51 couples, 3 couples parmi 51 (5,9%)
avaient une insertion et 1 couple (2%) avait le syndrome de chromosome 20 en
anneau (Stephenson, 2002).
Une étude en 1975 a porté sur 1500
échantillons de fausses couches, 61% d'eux ont contenaient un caryotype
anormal avec des trisomies, monosomie, triploïdie, ou
tétraploïdie (Boue, 1975). La plupart des aneuploïdies sont
d'origine maternelle et augmentent en fonction de l'âge (Nussbaum, 2016).
Franasiak et ses collaborateurs ont examiné les résultats du
dépistage génétique de la pré-implantation de 15
169 embryons biopsiés au stade du blastocyste qui ont été
attribués par 2701 patients (Franasiak, 2014), parmi les 6168
échantillons aneuploïdes, les erreurs impliquant un seul chromosome
étaient les plus fréquemment observées (63,7%), suivies de
2 chromosomes (19,9%) et de 3 chromosomes ou plus (16,3%). La
probabilité qu'un embryon soit qualifié d'anormal était
significativement associé à l'augmentation de l'âge de la
femme. Le taux d'aneuploïdie était également associé
à la structure chromosomique : les chromosomes acrocentriques
présentaient les taux d'aneuploïdie les plus élevés,
suivis des chromosomes métacentriques et enfin les chromosomes
submétacentriques (Franasiak, 2014).
Tableau I : Estimation de l'incidence des
anomalies caryotypiques
à propos de 10 000 grossesse (Nussbaum et
al., 2016).
|
Total
|
incidence
10,000
|
Avortement spontané (%)
1500 (15)
|
vivants
8500
|
|
Chromosomes normaux
|
9200
|
750 (8)
|
8450
|
|
Chromosomes anormaux
|
800
|
750 (94)
|
50
|
|
Anomalies spécifiques
|
|
|
|
|
Polyploïdie
|
170
|
170 (100)
|
0
|
|
45,X
|
140
|
139 (99)
|
1
|
|
Trisomie 16
|
112
|
112 (100)
|
0
|
|
Trisomie 18
|
20
|
19 (95)
|
1
|
|
Trisomie 21
|
45
|
35 (78)
|
10
|
|
Trisomie (autres)
|
209
|
208 (99.5)
|
1
|
|
47,XXY; 47,XXX; 47,XYY
|
19
|
4 (21)
|
15
|
|
Réarrangement déséquilibré
|
27
|
23 (85)
|
4
|
|
Réarrangement équilibré
|
19
|
3 (16)
|
16
|
|
Autres
|
39
|
37 (95)
|
2
|
71
Résultats et discussion
Les trisomies autosomales sont le résultat des erreurs
méiotiques maternelles, ces trisomies touchent majoritairement les
chromosomes 16, 22, 21, 15, 18 et 2 (Hardy, 2015). Une étude en Inde-New
Delhi sur 742 couples entre la période de 1990-2003 a donné les
résultats suivants : 9 sujets parmi les 742 couples (17,3%) ont
été porteurs des anomalies chromosomiques numériques, 3
sujets (33,3%) avaient une monosomie (45,X), 3 autres sujets (33,3%)
étaient porteurs du syndrome (46,XXX), et un sujet (13,2%) porteur la
mosaïque (46,XXY) (Dubey et al., 2005). Le mosaïsme est la
conséquence des erreurs mitotiques, et qui lors de sa présence
touche au moins deux lignées cellulaires d'un foetus au cours du
développement (Hardy et al, 2015). Ces anomalies peuvent aussi
survenir suite à un échec de recombinaison, d'une
séparation prématurée des chromatides soeurs mais la non
disjonction méiotique reste la cause la plus fréquente
d'aneuploïdie. Dans les produits de conception, au moins 50% de toutes les
fausses couches sont associées à des anomalies chromosomiques de
nombre : trisomie, polyploïdie et monosomie X. Une analyse
rétrospective cytogénétique standard des chromosomes
observés en bande GTG obtenus à partir de produits de conception
d'un total de 1000 échantillons a été
réalisée entre 2007 à 2015. Un total de 501 cas (50,1%)
présentant des anomalies chromosomiques ont été
identifiés. Les anomalies chromosomiques détectées
comprenaient 59,7% des trisomies, 22% des polyploïdies, 7,5% des
monosomies, 7% des anomalies structurelles déséquilibrées
et 3,8% des aneuploïdies doubles. Les trisomies autosomiques les plus
courantes étaient les trisomies des chromosomes 16, 21, 22, 13, 15 et
18. Les aneuploïdies des chromosomes sexuels ont été
représentées par le caryotype Turnérien typique (45,XO)
dans 38 cas, ce qui représente 10,7% de toutes les aneuploïdies.
D'autres aneuploïdies des chromosomes sexuels incluaient une polysomie du
chromosome X (de 2 à 5 copies) (0,8% de toutes les aneuploïdies).
Des aneuploïdies doubles ont été observées dans 19
cas, et des caryotypes mosaïques ont été observés
dans 61 cas (6,1%) (Larysa et al.,2017). La figure 23,
ci-après, illustre l'incidence des trisomies dans les produits de
fausses couches spontanées en fonction des autosomes
étudiés.
72
Résultats et discussion
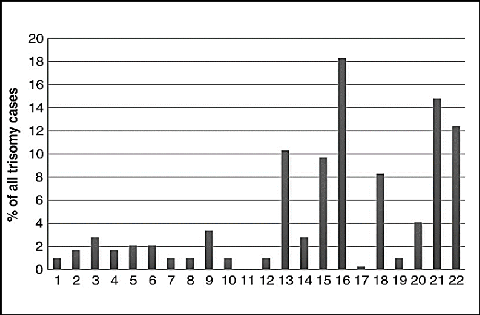
Figure 23 : Distribution des anomalies
autosomiques (trisomies) détectées dans
1000
échantillons de produits des fausses couches (Larysa et al,
2017).
Ces différences de fréquence des anomalies
chromosomiques détectées par la cytogénétique
conventionnelle pourraient être dues à un âge maternel plus
élevé dans ces groupes car il y'a une corrélation entre
l'âge maternel avancé et l'augmentation de la fréquence des
anomalies chromosomiques dans les ovocytes, les embryons
préimplantatoires et le produit de conception. La trisomie du chromosome
11 n'a pas été observée dans le groupe
étudié, bien qu'elle ait été rarement
décrite dans certaines études. La rareté de la trisomie du
chromosome 11 dans les produit de conception peut être expliquée
à la fois par la faible fréquence de non-disjonction
méiotique du chromosome 11 par rapport aux chromosomes (Rodriguez-Purata
et al., 2015). La fréquence globale de la monosomie du
chromosome X était de 7,5%. Une telle incidence semble assez constante
dans différentes études de différents groupes, ce qui peut
s'expliquer par le fait que le risque de monosomie X n'est pas influencé
par l'âge (Sahoo et al., 2017). Plusieurs études ont
montré que la non-disjonction chromosomique maternelle est la cause
prédominante de la double aneuploïdie (Li et al.,
2005).
73
Résultats et discussion
Dans une étude portant sur 1309 femmes qui ont
déjà subi deux ou plus de pertes de grossesse au cours du premier
trimestre, l'analyse chromosomique des produits de conception a montré
que la fréquence des caryotypes embryonnaires normaux a augmenté
à mesure que le nombre de fausses couches augmentait (Goldstein et
al., 2017).
Le risque de la survenue des ASR peut être
indépendant des anomalies chromosomiques maternelles, car des
études ont révélé la relation entre la
qualité du sperme et la capacité de l'embryon à atteindre
le stade blastocyste et sa progression vers l'implantation (Jeve, 2014).
Rubio et al après avoir analysé la constitution
chromosomique de 12 couples qui sont subi des ASR, ont signalé une
augmentation de la fréquence des diploïdies et des disomies dans
les échantillons spermiques des conjoints. Ces données ont
été confirmé par Carell et al (Carell et al.,
2003).
Agarwal et al ont suggéré que la
micro-délétion du facteur azoospermique (AZF) situé au
niveau du bras long du chromosome Y et qui est essentiel pour une
spermatogénèse normale peut augmenter le risque de la survenu des
anomalies chromosomiques et donc provoquer un avortement (Agarwal et al.,
2015). Une autre étude sur des échantillons de sperme de 11
partenaires qui ont vécu des ASR, a révélé une
augmentation significative des erreurs méiotiques du chromosome 16,
induisant ainsi l'augmentation de la survenue des disomies chez 60% des
patients. Ainsi, la non disjonction méiotique du chromosome 16
paternelle peut exercer une influence sur la survenu des aneuploïdies
foetales de façon similaire par rapport à la non disjonction
méiotique du chromosome 16 maternelle (Neusse, 2015).
Certaines mutations génétiques, telles que les
troubles autosomiques dominants conduisant à la dystrophie myotonique,
peut prédisposer les patients à l'infertilité ou
même aux ASR. Autres troubles autosomaux dominants associés aux
ASR parmi lesquels : la dysplasie squelettique mortelle, troubles du tissu
conjonctif ou des anomalies hématologiques, y compris les
altérations du fibrinogène, carence en facteur XIII ou
anémie falciforme. En 2004, Baek et al ont décrit 30
gènes impliqués dans des mécanismes d'immunité,
d'angiogenèse et d'apoptose montrant des différents niveaux
d'expression entre un groupe de femme à grossesse normal et un groupe de
patientes qui ont présenté des ASR (Baek, 2004). Xiaonhan et
al ont récemment publié une grande méta-analyse dans
laquelle 53 polymorphismes ou variants géniques de 37 gènes ont
été associés à ces dysfonctionnements de la
reproduction (Xiaonhan, 2017).
74
Résultats et discussion
Des techniques moléculaires telles que les puces ADN
microarray, l'hybridation génomique comparative et le
séquençage de nouvelle génération ont permis la
mise en évidence de gènes pouvant être associés aux
ASR, ces gène sont sujets à des polymorphismes
nucléotidiques, supposés délétères, qui
peuvent donc être la cause d'une fausse couche. Parmi les gènes
identifiés : AR, DNMT3, FOXP3, CGB5,
NLRP7, TIMP2 et CTNNA3 (Porras-Dorantes, 2017). Une
étude auprès de 428 cas entre 1990 et 2015 a évalué
l'effet de 472 variants dans 187 gènes. Les chercheurs ont
signalé une association entre la ASR et 21 variants des gènes
impliqués dans la réponse immunitaire (IFNG, IL10, KIR2DS2,
KIR2DS3, KIR2DS4, MBL, TNF), dans la coagulation (F2, F5, PAI-1,
PROZ), dans le métabolisme (GST1, MTHFR) et dans
l'angiogenèse (NOS3, VEGFA) (Pereza, 2017). Une
méta-analyse menée par Xu et al a montré que le
polymorphisme du gène VEGF associé à une
diminution des taux sériques de la protéine VEGF
angiogénique augmentent la susceptibilité maternelle
vis-à-vis les ASR et ce en vue du rôle crucial de la
protéine codée par ce gène dans l'angiogenèse
placentaire et l'implantation embryonnaire (Xu et al., 2015).
Des chercheurs ont mené des études pour
évaluer la relation entre les mariages consanguins et les ASR. Turki
et al, en Arabie saoudite, ont décrit une corrélation
statistiquement significative entre les mariages consanguins et les fausses
couches spontanées récurrentes (Turki et al., 2016).
L'effet de ces unions entre apparentés, particulièrement
répandus dans certains pays arabo-musulmans, sur les ASR, doit
être mieux précisé.
L'hybridation fluorescente in situ (FISH),
l'hybridation génomique comparative (CGH), la détection de
polymorphisme nucléotidique unique (SNP), la réaction de
polymérisation en chaine (PCR) quantitative (qPCR) sont des techniques
moléculaires capables de détecter les
microdélétions et les microduplications contrairement aux
anciennes techniques, et ils peuvent également détecter les
anomalies même en cas d'échec de culture ou de contamination.
Après avoir analysé les différences entre les techniques
de diagnostic prénatal, des auteurs ont rapporté des
fréquences de diagnostic de 2,5 à 4,2% avec le caryotype, alors
que des fréquences de 5,3 à 15% ont été
rapportées avec les autres techniques moléculaires. Par contre,
dans une revue systématique de Van den Berg et al, aucune
anomalie chromosomique n'a été détectée par les
techniques moléculaires, ce qui suggère que ces derniers
pourraient être utiles comme un outil complémentaire, mais ne
remplace jamais le caryotype (Chu et al., 2016).
75
Résultats et discussion
Les ASR inexpliqués peuvent être une condition
difficile et frustrante pour les patients et les cliniciens. En effet, il
existe deux types distincts d'ASR inexpliqués, les types I et II : l'ASR
inexpliqué de type I fait référence à des FCS qui
se produisent principalement par hasard, chez des femmes qui n'ont pas de
pathologie sous-jacente spécifique. Ce type a un pronostic relativement
bon par rapport aux femmes du même âge et aucune intervention n'est
nécessaire. Quant à l'ASR inexpliqué de type II, il fait
référence à des FCS qui surviennent en raison d'une
pathologie sous-jacente qui n'est pas actuellement identifiée par des
investigations cliniques de routine ou en raison de facteurs de risque
importants liés à l'environnement et au mode de vie. Ce type a un
pronostic plus mauvais, en comparaison avec le premier, pour les femmes du
même âge (Saravelos et Regan, 2014). Il est donc raisonnable de
supposer qu'une proportion de femmes atteintes d'ASR inexpliqués
(environ une sur trois) peut avoir des facteurs de risque environnementaux
importants ou des pathologies endogènes, non détectées par
les enquêtes de routine actuelles, augmentant ainsi le risque de survenu
de fausses couches spontanées à répétition
(Saravelos et Regan, 2014).
À titre d'exemples, plusieurs études ont
suggéré que des facteurs tels que l'obésité, le
tabagisme, l'alcool, la caféine et l'exposition à certains
risques professionnels peuvent augmenter le risque d'ASR, ce qui pourrait
principalement concerner le groupe des ASR inexpliqués. D'autres
études expérimentales ont montré une augmentation du
nombre de cellules tueuses naturelles utérines chez les femmes ayant
subi des ASR inexpliqués. Cependant, jusqu'à présent, ces
associations et leurs traitements associés restent sans fondement
(Saravelos et Regan, 2011 ; 2012).
Le plus souvent, la fausse couche ne nécessite pas de
prise en charge spécifique : pas de médicalisation, pas
d'hospitalisation car le processus d'expulsion se fait tout seul. Le col de
l'utérus s'ouvre, des débris ovulaires, l'embryon ou le foetus
est expulsé, sous l'effet de contractions utérines plus ou moins
douloureuses et accompagnées de saignements plus ou moins abondants.
Mais il arrive parfois que le processus d'expulsion est incomplet, ne se
produit pas spontanément. Dans ces cas, une prise en charge
médicalisée est nécessaire (CNGOF, 2006). Selon ces
mêmes recommandations, trois types de prise en charge sont
déterminées suivant les institutions, le choix sera laissé
à la patiente ou une méthode sera privilégiée en
fonction du type de fausse couche.
76
Résultats et discussion
- L'expectative : c'est l'attente de
l'expulsion spontanée de l'embryon sans intervention
médicalisée. Le délai de l'expulsion peut être
très long, ce qui est souvent difficile à vivre pour les couples.
Pour Lejeune et Carbonne (2007), elle est possible lorsque l'embryon n'est pas
visible ou qu'il mesure moins de 25 mm (vers 9 SA).
- Interventions médicales :
l'intervention médicamenteuse qui correspond à
l'utilisation de prostaglandines alors que l'intervention chirurgicale
correspondant à l'aspiration du contenu utérin après
dilatation cervicale favorisée par la prise de misoprostol quelques
heures avant l'intervention. À partir d'un certain âge
gestationnel, elle est remplacée par un curetage évacuateur
(CNGOF, 2006).
D'après le CNGOF, la prise en charge
hospitalière consiste à surveiller chez la patiente ses signes
vitaux, les pertes sanguines, les effets secondaires du traitement
médicamenteux s'il est donné. Elle permet de d'apporter une
couverture antalgique, de réaliser les soins post-opératoires
(évaluation de la douleur, signes vitaux, mobilisation, reprise de la
diurèse et du transit) de vérifier par échographie
l'expulsion totale de l'embryon ou du foetus. Un rendez-vous de contrôle
est prévu 1 mois après la fausse couche précoce. Il est
parfois possible que la prise en charge, expectative ou médicamenteuse,
ait lieu en ambulatoire. Elle est proposée en fonction de la
capacité de la patiente à comprendre l'information et à
appréhender les risques. Elle est informée au préalable
sur les démarches à suivre en cas de complications. Un
contrôle, le plus souvent, une semaine après l'expulsion est
prévu avec un contrôle échographique (CNGOF, 2006).
La présence d'une anomalie chromosomique
équilibrée chez un des parents constitue une des indications
principales du DPN. Ce diagnostic s'entend sur l'ensemble des techniques
permettant de reconnaître, à un moment plus ou moins
précoce de la vie intra-utérine, la pathologie dont l'embryon ou
le foetus est ou sera atteint, soit par l'étude de sa morphologie
(échographie), soit par des examens biologiques (caryotype, dosages
enzymatiques, biologie moléculaire). Différentes méthodes
sont actuellement envisagées pour l'étude
cytogénétique : choriocentèse (prélèvement
de villosités choriales), amniocentèse ou cordocentèse
(Frikha et al., 2012).
77
Résultats et discussion
L'approche thérapeutique adéquate pour anticiper
les anomalies chromosomiques chez le produit de conception serait un DPI. Cela
nécessite le recours à une FIV. Son grand avantage est de ne pas
générer d'interruption de grossesse puisque seuls les embryons
indemnes sont transférés dans l'utérus maternel. Il
apparaît donc comme une alternative au DPN pour les couples ayant eu
à vivre des interruptions de grossesse itératives ou
confrontés à une maladie liée à l'X. Il peut aussi
apparaître comme une solution pour l'homme ou la femme atteints qui ne
peuvent se résoudre à empêcher la naissance d'un enfant
ayant le même handicap ou qui n'envisagent pas de transmettre une
pathologie mineure ou à révélation tardive à leurs
enfants. Toutefois, en raison de la complexité des maladies
génétiques il reste en pratique limité à un petit
nombre de maladies et ne concerne qu'un faible nombre de couples (Hanson et
al., 2003).
Selon le Royal College of Obstetricians & Gynecologists,
le diagnostic génétique préimplantatoire permet de
détecter la présence d'éventuelles anomalies
génétiques ou chromosomiques dans les embryons conçus
après fécondation in vitro afin de sélectionner
et transférer un embryon sain, il a été proposé
comme traitement et solution pour les parents souffrant d'ASR et ceux qui sont
porteurs d'une translocation (RCOG, 2011). Cependant, la pertinence exact de
l'intérêt du DPI pour améliorer les taux de réussite
de grossesses menées à termes chez des couples porteurs
d'anomalies chromosomiques reste à confirmer. Lalioti et al ont
suggéré que le DPI réduit le taux des fausses couches chez
les couples atteints des FCSR induites par un déséquilibre
chromosomique chez les patients âgés plus de 35 ans (Lalioti,
2008). En conclusion, et en raison de l'absence des données suffisantes
et des preuves clairement établies, la conception assistée avec
le dépistage génétique préimplantatoire comme
traitement préventif proposé dans le cadre des ASR n'est pas
recommandée.

78
|
|



