I.1.2.1.2. Tolérance immunologique de l'embryon
L'embryon est composé à 50% de matériel
génétique paternel qui devrait être alors
considéré comme «non soi» par l'organisme maternel.
Ainsi, il serait susceptible d'être détruit au cours d'une
réaction immunitaire à médiation cellulaire faisant
intervenir les cellules T tueuses spécifiques ou les cellules NK
(Natural Killers). Cependant, il existe une protection de l'embryon contre le
rejet immunologique par les tissus maternels.
Les cellules NK utérines produisent des cytokines
telles que CSF-1 (Colony Stimulating Factor 1) favorisant la croissance
placentaire. De plus, l'antigénicité du trophoblaste est
réduite en début de gestation.
Chez les ruminants, les antigènes du Complexe Majeur
d'Histocompatibilité de classe 1 ne s'expriment pas sur les
gamètes et sur les cellules externes de l'embryon au début du
développement embryonnaire. Ils s'exprimeront plus tard lorsque les
couches externes du placenta se différencient mais cela reste faible.
Ainsi, les cellules T n'identifient pas le trophoblaste et donc l'embryon comme
un élément étranger. Pour finir, Il existe aussi une
immunosuppression à l'interface embryomaternelle. Le trophoblaste est
capable de neutraliser le complément, indispensable à l'action
des anticorps cytolytiques. Parallèlement, des mécanismes de
défense contre un rejet à médiation cellulaire existent
[POLL, 2007].
Par ailleurs, en présence de fortes concentrations de
progestérones à l'interface embryo-maternelle et grâce
à l'existence de protéines de surfaces toxiques pour les
lymphocytes T, les cellules du trophoblaste sont résistantes à la
lyse par les cellules tueuses et développent une résistance
à l'apoptose. Les cellules du placenta sécrètent
également des facteurs locaux immunosuppresseurs. Il s'agit de
l'INFô sécrété par le conceptus au début de
l'implantation.
I.1.2.2. Adaptation de l'organisme maternel à la
gestation
L'organisme maternel s'adapte à l'état de gestation
par des modifications morphologiques, fonctionnelles et métaboliques.
I.1.2.2.1. Modifications morphologiques
La gestation crée au niveau de l'organisme maternel un
état physiologique nouveau et entraîne une série de
modifications morphologiques plus spécialement localisées au
niveau des organes génitaux.
> L'utérus
L'utérus présente une série de
modifications de forme, de volume, de poids, de situation, de rapport et
d'aspect. Chez la vache où l'uniparité est pratiquement de
règle, le développement plus important de la corne gravide rend
l'utérus asymétrique dès le deuxième et surtout le
troisième mois de gestation. Les rapports de l'utérus avec les
viscères abdominaux et la paroi abdominale se modifient au fur et
à mesure que se poursuit l'état gestatif, il se loge entre la
face droite du rumen et la paroi abdominale chez la vache [DERI VAUX et
ECTORS, 1980].
L'augmentation du poids de l'utérus et sa distension
s'accompagnent d'un amincissement de la paroi musculaire. Les artères
utérine et utéro-ovarienne s'allongent, s'hypertrophient et
deviennent fluctueuses; l'artère utérine devient nettement
perceptible dans l'épaisseur du ligament large et l'ondée
sanguine, particulièrement importante à partir du
quatrième mois de gestation chez la vache.
> Le col utérin
Suite aux modifications utérines, le vagin s'allonge
progressivement et le col utérin finit par se situer en avant du bord
antérieur du pubis. Le col est obturé par un mucus consistant,
très épais qui est un produit de sécrétion des
glandes cervicales; constituant un bouchon muqueux dont la liquéfaction
se produit au moment de la parturition [GAYRARD, 2007].
> Les ovaires
Au niveau des ovaires, il y a la mise en place du corps jaune
gestatif ce qui entraîne l'arrêt des cycles ovariens.
> Les glandes mammaires
Les mamelles s'hypertrophient progressivement avec le
développement des canaux galactophores et des acini, et en fin de
gestation, les tissus pelviens s'oedématient et les ligaments
sacro-sciatiques se ramollissent et s'affaissent pour donner lieu à ce
qui est appelé «l'état croqué» [GAYRARD,
2007].
I.1.2.2.2. Modifications fonctionnelles
L'état de gestation entraîne d'importantes
modifications fonctionnelles au niveau de l'organisme maternel. Les fonctions
les plus concernées sont:
+ la respiration: la consommation d'oxygène par le
foetus entraîne une hypoxie avec comme résultat une
hyperventilation due essentiellement à une augmentation de la
fréquence respiratoire.
+ la circulation: il y a une irrigation plus importante de
l'utérus et des mamelles et une augmentation de la fréquence
cardiaque.
+ la fonction endocrine: il y a une hyperactivité des
glandes thyroïdes, surrénales et adénohypophyses.
+ la fonction rénale: il y a une augmentation de la
diurèse, une tendance à la rétention hydrique,
sodée et glycosurie. Ces modifications sont le résultat d'une
hyperactivité de la glande surrénale [GAYRARD,
2007].
I.1.2.2.3. Modifications métaboliques
L'état de gestation entraîne des modifications au
niveau du métabolisme qui se traduisent surtout par une augmentation de
l'anabolisme gravidique. La stimulation de l'anabolisme protidique
entraîne un bilan azoté positif; l'anabolisme des lipides et des
glucides est aussi augmenté. Cet anabolisme sert à la croissance
du foetus au dernier tiers de gestation vu que 75% du poids à la
naissance est acquis au dernier tiers de gestation [GAYRARD,
2007].
I.2. Durée de la gestation
La durée de gestation correspond au nombre de jours
écoulé entre la fécondation et la mise bas.
La durée de la gestation est variable en fonction de
l'espèce, de la race et de l'individu.
Chez la Holstein, elle est de 275 #177; 15 jours
[KAMGA-WALADJO, 2003]. Chez les montbéliardes,
DIOUF (1995) a observé une durée de gestation de
276#177;10 jours. De même, BADAI (2008) au Cameroun chez
la Holstein, Métisse Holstein et Métisse Montbéliarde a
observé respectivement la durée de gestation de 276,8 #177; 23,6
jours; 277,1 #177; 11,4 jours et 285,3 #177; 9,8 jours.
Notons que dans une même espèce, la durée de
gestation varie en fonction :
~ de la taille de la portée : chez la vache, la
durée de la gestation est plus courte en cas de naissance
gémellaire (de 3 à 6 jours) ;
~ de l'âge de la femelle: la durée de la gestation
est plus courte chez les primipares (de 2 à 3 jours chez la vache);
~ du sexe du foetus: chez la vache, la gestation est
allongée de 2 à 3 jours chez les foetus mâles
[DRAME, 1996].
Selon DIOUF (1991), la durée de
gestation est de 293 #177; 2jours chez le zébu, et de 288,2 #177; 6,8
jours chez la N'dama. KAMGA-WALADJO et al. (2006) en
Guinée, chez la N'dama ont observé une durée de gestation
de 280,1 #177; 8 jours, de 264,5 #177; 3,5 jours en gestation gémellaire
et de 255 jours pour une portée de triplé. Retenons que chez la
vache, la gestation dure en moyenne 282 jours, avec des extrêmes de 277
à 295 jours.
I.3. Régulation hormonale de la
gestation
Une fois que le signal embryonnaire est identifié par
l'organisme maternel, l'événement essentiel du maintien de la
progestation et de la gestation est la persistance du corps jaune pendant toute
ou une partie de la gestation, avec corrélativement la persistance d'une
production en quantité importante de la progestérone qui permet
le maintien de l'état de gestation par blocage de la
sécrétion de GnRH (Gonadotropin Releasing Hormon) empêchant
toute décharge ovulante de LH, ce qui suspend l'activité sexuelle
cyclique de la femelle.
Ainsi, un équilibre hormonal gravidique
s'établit, permettant le maintien de la gestation. Chez toutes les
espèces animales, la gestation est caractérisée par une
augmentation considérable de la progestéronémie; la
principale source de la progestérone en début de gestation est le
corps jaune.
Le foetus intervient dans le maintien de l'équilibre
hormonal gravidique en inhibant l'activité lutéolytique de la
PGF2á d'origine utérine. Dès le début de la
gestation, l'embryon inhibe cette activité lutéolytique de
l'utérus. Chez les ruminants, le trophoblaste sécrète une
protéine appelée la trophoblastine ou Trophoblastin Protein 1 qui
neutralise l'activité lutéolytique de la PGF2á
[MARTIAL cité par THIAM, 1996].
I.4. Hormonologie de la gestation
Diverses hormones (progestérone, cortisol,
prostaglandines, prolactine, hormone somatotrophine, etc..) et diverses
protéines et glycoprotéines sont impliquées dans divers
processus biologiques tels que l'établissement de gestation, le maintien
du corps jaune, la croissance foetale et mammaire.
I.4.1. Early Pregnancy Factor
De nature glycoprotéique, l'Early Pregnancy Factor
(EPF) encore appelé early conception factor (ECP)
apparaît quelques heures après la fécondation dans le sang
de la plupart des espèces animales dont la vache [NANCARROW et
al., 1981], la truie [MORTON et al., 1983],
et la brebis [CLARKE et al., 1980]. Ce
facteur existe en fait sous deux formes: l'une sécrétée
par l'ovaire ipsilatéral à la corne gestante (EPF-B)
[NANCARROW et al., 1981]et l'autre
synthétisée par l'oviducte (EPF-A) [MORTON et
al., 1980]. Leur synthèse ovarienne est initiée
par un petit peptide appelé zygotine [OROZCO et al.,
1986] et est donc indépendante de la présence du
placenta.
Il se pourrait que ce facteur contribue à diminuer
l'immunocompétence des lymphocytes en début de gestation et ainsi
faciliter la reconnaissance immunologique de l'embryon par l'organisme maternel
[MORTON et al., 1984]. La détermination de sa
concentration constituerait un bon moyen d'identification d'une
mortalité embryonnaire si ce n'était le manque de
reproductibilité de son évaluation plasmatique, imputable au fait
qu'elle est influencée par de nombreux facteurs biologiques.
I.4.2. Zygotine
Identifiée chez la brebis [MORTON et
al., 1979], la truie [MORTON et al.,
1983] et la vache [NANCARROW et WALLACE, 1980], la
zygotine ou EPAF (Embryo Platelet Activating Factor) possède des
propriétés chimiques, biochimiques et physiologiques comparables
à celles du PAF (Platelet Activating Factor), facteur produit notamment
par les neutrophiles, le foie et les muscles lisses [HANAHAN,
1986].
Elle induit la production par l'oviducte et l'ovaire porteur
du corps jaune d'un facteur précoce de la gestation appelé
EPF.
1.4.3. Interféron tau bovin
L'interféron tau (IFNô) bovin est une des
principales protéines sécrétées par le conceptus
bovin âgé de 16 à 25 jours [HELMER et
al., 1987]. Le mécanisme
d'action de l'IFNô inclut l'inhibition des récepteurs à
l'oestradiol, la réduction conséquente des récepteurs
d'ocytocine, et elle induit localement l'inhibition des
sécrétions de PGF2á et diminue la sensibilité du
corps jaune à l'action lutéolytique des PGF2á
[HANSEN et al., 1999].
Malgré l'importance de l'IFNô dans
l'établissement de la gestation chez la vache, cette protéine ne
présente pas d'intérêt en tant que test diagnostic de
gestation car aucune méthode ne permet de la détecter dans la
circulation sanguine maternelle [AYAD et al.,
2006].
I.4.4. Hormone chorionique somato-mammotrope
Le placenta produit une hormone lactogène placentaire
(PL), connue également sous le nom hormone chorionique
somato-mammotrope. Cette hormone présente une homologie structurelle et
fonctionnelle avec l'hormone de croissance et la prolactine (PRL)
[AYAD, 2006]. Les premières publications qui ont
rapporté l'existence d'une hormone placentaire à activité
endocrine multiple remontent aux travaux de SELYE et al.
(1933) lesquels, dès cette époque, ont montré
chez la rate le rôle non essentiel de l'hypophyse dans le maintien de la
gestation et le déclenchement de la lactation.
Chez la vache, l'existence d'une réponse
lactogénique au niveau des cotylédons à des stades
gestatifs divers a été décrite pour la première
fois en 1976 par BUTTLE et
FORSYTH.
Après cinq jours de culture, ces auteurs ont obtenu une
réponse lactogénique correspondant à environ 300ng de
prolactine bovine par millilitre de milieu. Cette glycoprotéine
possède plusieurs isoformes de masses moléculaires
s'étalant de 30 à 34kDa, elle est secrétée par les
cellules binucléées et trinucléées du placenta
[ARIMA et BREMEL, 1983]. Le dosage radioimmunologique (RIA) du
bPL (Lactogène placentaire bovine) a été décrit par
BECKERS et al.
(1982) pour mesurer les concentrations de l'hormone chez les
vaches et leurs foetus.
Le bPL devient dosable dans le sérum maternel à
un moment très variable selon les individus allant du
26ème au 110ème jour après
fécondation. Les concentrations maternelles de bPL augmentent
progressivement pour atteindre les valeurs de 1 à 2 ng/ml aux environs
de la parturition. Les faibles concentrations maternelles contrastent aussi
avec celles observées chez le foetus, lesquelles varient de 25 à
30 ng/ml au 90ème jour pour ensuite diminuer graduellement et
rester à 5 ng/ml à la période prénatale
(figure 3).
La liaison du bPL à des récepteurs
présents dans la glande mammaire, le foie, l'endomètre et le
corps jaune a été démontrée par
BECKERS (1983). Dans la glande mammaire, le
bPL paraît exercer une influence sur le développement du tissu
lobuloalvéolaire. Sa capacité lactogène a
été démontrée in vitro par FORSYTH
(1986). D'après HAYDEN et
al. (1979), la production
laitière chez les ovins est corrélée avec la
sécrétion de l'hormone entre la 1 1ème semaine
de gestation et la mise-bas.
L'apparition tardive de l'hormone lactogène placentaire
dans le sang maternel des bovins confère toutefois à ce dosage
peu d'intérêt pour le diagnostic de gestation et restreint son
utilisation à un diagnostic tardif de gestation.
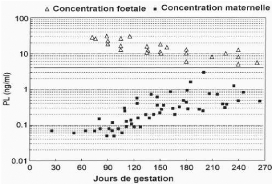
Figure 3: Profils plasmatiques de l'hormone
lactogène placentaire bovine chez la mère et le foetus.
[Source: BECKERS et al., 1982]
I.4.4. Progestérone
I.4.4.1. Définition
La progestérone est une hormone
stéroïdienne à 21 atomes de carbone, et d'un poids
moléculaire de 314 daltons; elle provient du cholestérol sanguin
et de l'acétate. La progestérone, la 20â (béta)
hydroxyprogestérone et la 1 7-hydroxyprogestérone constituent les
3 progestagènes naturels chez la vache et ont en commun les 4 cycles du
cyclopentanoperhydrophénanthrène ou noyau stérane. La
progestérone reste le chef de file des progestagènes et le plus
important sur le plan physiologique.
I.4.4.2. Biosynthèse
La progestérone est synthétisée et
secrétée essentiellement par les cellules lutéales du
corps jaune et le placenta mis en place suite à l'implantation de
l'embryon. Le principal précurseur est le cholestérol. La
transformation du cholestérol en progestérone passe par la
prégnénolone obtenue suite à 2 hydroxylations en
C20 et C22 et grâce à la cholestérol-20
desmolase qui scinde le cholestérol en acide isocaproïque et en
5â-prégnane-3á-ol-20 one (prégnénolone)
[HORTON et al., 1994].
I.4.4.3. Régulation
Le contrôle de la biosynthèse de la
progestérone dépend en grande partie de l'équilibre entre
les hormones secrétées par l'hypothalamus, l'hypophyse, l'ovaire
et l'utérus (Figure 4).L'hypothalamus secrète le GnRH qui
commande la libération épisodique des hormones gonadotropes LH
(Luteinizing Hormon) et FSH (Follicule Stimulating Hormon) dans la circulation
générale. La LH est sécrétée de façon
pulsatile par l'hypophyse et stimule la libération de l'oestradiol et de
la progestérone par l'ovaire.
Quant à la FSH, elle permet la croissance folliculaire.
Sa sécrétion est régulée par celle d'oestradiol et
d'inhibine secrétées par le follicule. La progestérone
exerce une rétroaction sur la sécrétion hypophysaire de
GnRH et affecte ainsi la synthèse de LH et de FSH. Ce feed-back
négatif de la progestérone cessera à la lutéolyse
et une nouvelle phase folliculaire sera initiée par la FSH.
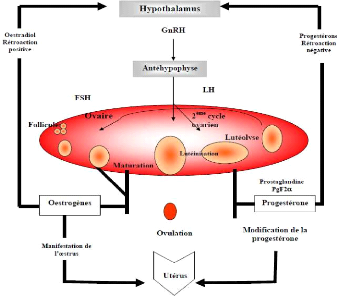
Figure 4: Régulation de la
biosynthèse des principales hormones
ovariennes.
[Source: UNCEIA, 2005]
I.4.5. Prostaglandine E
Le rôle exact de la prostaglandine E produite par les
blastocystes ovins et bovins [MARCUS, 1981; MILVAE et HANSEL, 1980]
reste à démontrer. Elle serait impliquée dans le
maintien de la gestation étant donné son effet lutéotrope
[SHELTON et al., 1990] et l'augmentation de sa
concentration dans la corne gestante après le 12ème
jour de gestation.
I.4.6. Trophoblastine
De nature protéique, la trophoblastine est
synthétisée par le trophectoderme [GODKIN et
al., 1984]. Ce facteur a été identifié
chez la brebis (oTP-1: ovine Trophoblast Protein -1) chez la chèvre
(cTP-1: caprine Trophoblast Protein-1) et chez la vache (bTP-1: bovine
Trophoblast Protein 1) [HELMER et al., 1987; MARTAL et
al., 1979; HEYMAN et al., 1984]. Une grande
homologie d'effets et de structures existent entre les trophoblastines de ces
espèces.
La trophoblastine est identifiée dans le liquide de
lavage de la cavité utérine vers le 8ème jour de gestation
chez la brebis [BAZER, 1989] et le 12ème
jour chez la vache [HUMBLOT et DALLA-PORTA, 1984; THATCHER et
al., 1985; BAZER, 1989]. Sa concentration augmente de
manière synchrone avec les changements morphologiques de l'embryon. Chez
la vache elle peut encore être détectée jusqu'au
38ème jour de gestation [BAZER, 1989].
I.4.7. Protéines spécifiques de la
gestation
I.4.7.1. Définition
Les protéines associées à la gestation
sont des molécules synthétisées par les cellules
binucléées du trophoblaste. Elles appartiennent à la
famille des protéases aspartiques. Elles possèdent une grande
similarité entre elles et sont au nombre de quatre à savoir la
PSPB (Pregnancy Specific Protein B), la PSP-60 (la protéine
sérique de gestation), la bPAG (Pregnancy Associated Glycoprotein) et la
SBU-3 identifiée pour la première fois par
GOGOLIN-EWENS et al.
(1986) et considérée comme restant
confinée dans les cellules binucléées.
Chez les bovins, la détection de ces protéines
associées à (ou spécifiques de) la gestation, dans la
circulation sanguine maternelle est utilisée couramment comme
méthode de diagnostic de gestation à partir du
30ème jour après la saillie ou l'insémination
artificielle [HUMBLOT et al., 1988 ; ZOLI et al.,
1992 ; MIALON et al., 1993].
Bien que des concentrations significatives de PAG puissent
être détectées chez certaines femelles à des stades
plus précoces, l'exactitude du diagnostic de gestation posé avant
le 30ème jour après la conception, peut être
compromise par des différences individuelles dans le profil de
sécrétion des PAGs par l'embryon en développement
[CHAVATTE-PALMER et al., 2006; SOUSA et al.,
2006], tout comme d'ailleurs par l'incidence élevée de
la mortalité embryonnaire durant cette période critique
[KUMMERFELD et al., 1978 ; SREENAN et DISKIN,
1983].
La mise au point de dosages radio-immunologiques chez la vache
[SASSER et al., 1986], la chèvre
[HUMBLOT et al., 1990], la brebis [RUDER et
al., 1988; EL AMIRI et al., 2004]
en rend l'intérêt particulièrement évident
pour le diagnostic de gestation et l'étude des avortements.
Par rapport au dosage de la progestérone, la
détermination de la concentration en PSPB ou PAG offre l'avantage de
pouvoir être réalisé quel que soit le stade de gestation
pour autant que le prélèvement ait été
effectué plus de 30 à 35 jours après
l'insémination. Le degré d'exactitude des diagnostics de
non-gestation est également plus élevé (85 %) [EL
AMIRI et al., 2004]. A l'inverse étant donné sa
demi-vie particulièrement longue surtout si la gestation a
été menée à son terme, il est impératif de
respecter au cours du postpartum une période d'attente de 100 jours pour
effectuer un diagnostic chez la vache [HUMBLOT et al., 1988;
HUMBLOT, 1991].
I.4.7.2. Biosynthèse
Les protéines et glycoprotéines associées
à la gestation sont synthétisées par les cellules
binucléées présentes dans les couches superficielles du
trophectoderme et plus précisément dans les granules de ces
cellules binucléées [ZOLI et al.,
1992]. Ces produits de synthèse sont stockés dans des
granules denses occupant plus de 50 % du cytoplasme [LEE et
AX, 1986] et relargués directement dans la circulation
maternelle après migration des cellules binucléées
(figure 5).
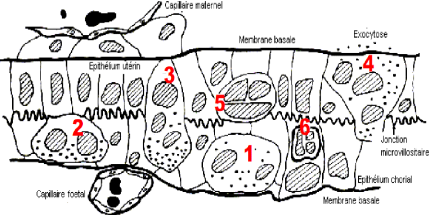
Figure 5: La migration des cellules
binucléées chez la vache: 1) cellule
binucléée; 2) contact avec les
microvillosités; 3) fusion avec les cellules
maternelles et formation de cellules trinucléées à vie
courte; 4) exocytose des granules; 5)
cellules trinucléées présentant un cytoplasme
réduit et un nucleus dense; 6) cellule
réabsorbée par le trophoctoderme [WOODING et WATHES,
1992].
I.4.7.3. Expression des PAGs durant la
gestation
Chez la vache gestante, les concentrations en PAG sont
détectables au plus tôt à partir des 1
9-22ème jours après conception pour atteindre des
concentrations de 3 à 6 ng/ml aux alentours des
33-37ème jours de gestation [PERENYI et al.,
2002], avec cependant de grandes variations individuelles. En
pratique, les prélèvements sont effectués à partir
du 35ème jour après la saillie parce que chez plus de
98% de vaches, la détection n'est possible qu'au 30ème
jour de l'insémination ou de la saillie fécondante [ZOLI
et al., 1992; LOPEZ GATIUS et al., 2007].
Le seuil de positivité est de 0,8 ng/ml chez les vaches
au 35ème jour de la conception. La concentration des PAGs
continue d'augmenter dans le sang maternel jusqu'au jour de la parturition.
Ainsi, TAINTURIER et al. (1996) ont
montré dans leur étude qu'à ce moment, les concentrations
atteignent 1400ng/ml alors que SOUSA et al.
(2003) ont montré des concentrations de l'ordre de
1018,04#177; 560,85 ng/ml chez le zébu azawak au Burkina- Faso
(Figure 6).
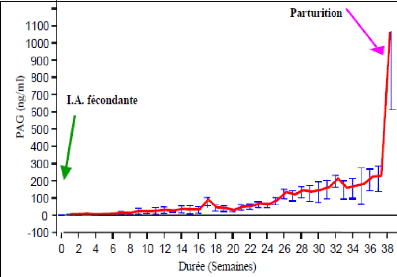
Figure 6: Profil moyen des PAGs au cours de la
gestation [Source: SOUSA, 2003]
I.4.7.4. Expression des PAGs après la
gestation
La cinétique des PAGs dans le sang maternel au cours du
post-partum se caractérise par la persistance d'une quantité
résiduelle importante de la protéine
(CHEMLI, 1999). Les PAGs ne disparaissent du
sang maternel qu'environ 120 jours après la parturition.
TAINTURIER (2000) indique que les concentrations passent de
1400 ng/ml à 165 ng/ml le 21ème jour du part, elles
disparaissent complètement entre 100 et 120 jours après la mise
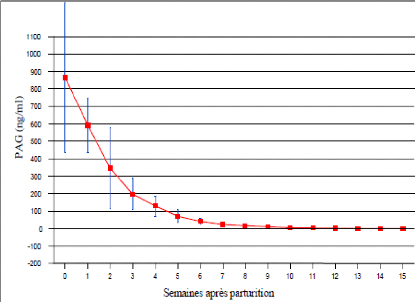
bas alors que chez le zébu Azawak [SOUSA, 2003], de la
1ère semaine de parturition à la
6ème semaine les concentrations des PAG chutent
considérablement: elles passent de 1018,04 #177; 850,85 ng/ml à
41,27 #177; 14,85 ng/ml (Figure 7).
Figure 7: Concentration des PAGs post-partum
chez 10 femelles zébus
Azawak. [Source: SOUSA,
2003]
I.4.8. Facteurs de croissance
Des multiples facteurs contrôlent de manière
autocrine ou paracrine le développement des premiers stades de l'embryon
[HEYNER et al., 1993; GANDOLFI, 1994] et la
différenciation endométriale tels le transforming growth factor,
l'insulin growth factor I et II, l'epidermal growth factor [PARIA et
al., 1990], l'insuline, le platelet derived growth factor, le
basic fibroblast growth factor [LARSON et al., 1992],
mais aussi une multitude d'autres protéines plus
spécifiques à l'oviducte (Oviduct Specific Protein). Il est
prématuré d'en envisager l'utilisation dans les milieux de
culture des embryons car les premières tentatives
réalisées n'ayant enregistré aucune amélioration du
développement embryonnaire [FLOOD et al.,
1993].
I.5. Déclenchement du part
La parturition ou mise bas correspond à l'ensemble des
phénomènes mécaniques et physiologiques qui aboutissent
à l'expulsion du ou des foetus et de ses annexes hors des voies
génitales, chez une femelle parvenue au terme de sa gestation.
L'ensemble des phénomènes mécaniques qui contribuent au
processus de mise bas est placé sous un contrôle endocrinien
(Figure 8). Ainsi, la mise bas intervient suite à la rupture de
l'équilibre hormonal gravidique, dont l'axe hypothalamo-hypophysaire du
foetus en est l'origine.
Une étude menée par DERIVAUX et ECTORS
(1980) montre qu'au moment de la mise bas, on observe une chute de la
progestéronémie, un pic d'oestrogènes, de
corticostéroïdes, de prolactine et une légère baisse
de concentration de LH.
I.5.1. Chute de la
progestéronémie
La chute de la progestéronémie lève
l'inhibition exercée par cette hormone sur les contractions
utérines. La progestéronémie chez la vache passe de 7
à 8 ng/ml à 1 ng/ml au moment du part [DERIVAUX et
ECTORS, 1980]. En effet, cette baisse se produit en deux phases, il
s'agit d'abord d'une réduction assez marquée puis une chute
très brutale due à la lyse du corps jaune gestatif dans les
dernières 48 heures. Cette chute de la progestéronémie en
fin de gestation est aussi signalée par MORALES et
al.(1988).
I.5.2. Augmentation des oestrogènes
Elle a lieu environ quarante deux heures (42h) avant la mise
bas et suit la chute brutale de la progestérone. On observe un pic
jusqu' à 5 ng/ml. Les oestrogènes à l'absence de
progestérone en forte quantité ont une action d'une part de
stimuler les contractions utérines, et favoriser la synthèse de
la PGF2á (par le placenta et l'utérus) qui a un effet
contracturant de l'utérus et dilatateur du col utérin, et d'autre
part elle exerce une action au niveau de la symphyse pelvienne par un
phénomène d'imbibition, qui est à l'origine des
relâchements des parois.
I.5.3. Augmentation de la cortisolémie
La cortisolémie maternelle augmente avec la
difficulté du vêlage; on peut donc supposer que l'augmentation de
la concentration du cortisol est une réponse maternelle au stress de la
parturition. Ainsi, sa concentration chez la vache passe de 4 à 6ng/ml
le jour du part [DERIVAUX et ECTORS, 1980]. Le cortisol agit
surtout sur la production placentaire d'oestrogènes qui vont augmenter
au moment de la parturition.
I.5.4. Augmentation de la concentration de la
prostaglandine
La concentration de la prostaglandine subit une très
forte hausse au moment du part, ce qui favorise une augmentation à la
fois du tonus de base des contractions et de leur fréquence
[MARTIER et al., 1986]. Ce sont les
oestrogènes qui stimulent la synthèse de prostaglandines de type
E, qui jouent un rôle dans le ramollissement du col, et de type F, qui
vont lyser le corps jaune et donc stopper sa production de progestérone,
puis provoquer les premières contractions myométriales une fois
que la progestérone aura cessé de bloquer la parturition.
I.5.5. Augmentation de la concentration
d'ocytocine
Le pic de l'ocytocine est atteint au moment de l'expulsion du
foetus. Elle est due d'une part aux modifications hormonales, et d'autre part
à une incitation nerveuse reflexe, appelée«reflexe de
Fergusson», issue des organes génitaux et due à la
dilatation du col et du vagin. DERIVAUX et ECTORS (1986)
montrent qu'une fois le foetus est engagé dans la filière
pelvienne, la distension du col et du vagin conduit à la
libération de l'ocytocine qui est un contracturant utérin,
contribuant à l'expulsion du foetus et surtout à la
délivrance.
I.5.6. Augmentation de la concentration des
PAGs
La concentration des PAGs continue d'augmenter dans le sang
maternel jusqu'au jour de la parturition. Ainsi, TAINTURIER et
al. (1996) ont montré dans leur étude
qu'à ce moment, les concentrations atteignent 1400ng/ml alors que
SOUSA et al. (2003) ont
montré des concentrations de l'ordre de 1018,04 #177; 560,85 ng/ml chez
le zébu azawak au Burkina Faso (Figure 7, page 22).
Cette augmentation très rapide de la concentration des
PAGs dans la circulation périphérique dans les jours qui
précèdent la mise-bas pourrait être liée aux
modifications physiologiques relatives au déclenchement de la
parturition. Elle pourrait être à l'origine des changements
chimiques préparant l'expulsion du placenta après la
parturition.
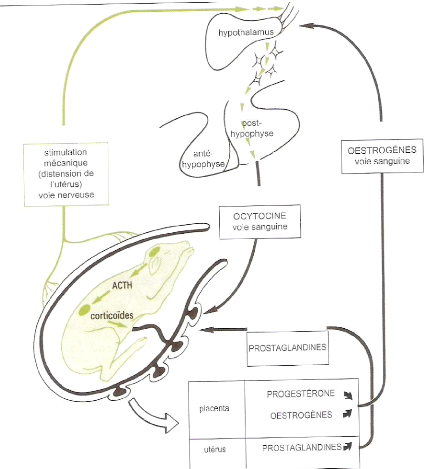
Figure 8: Régulation endocrinienne de la
parturition.
[Source: INSTITUT DE L'ELEVAGE,
2000]
Au terme de ce chapitre consacré à la
physiologie de la gestation, nous avons évoqué les principales
phases de la gestation, sa durée, sa régulation, ses hormones et
le déclanchement du part. Il en ressort que la gestation qui commence
par la fécondation et se termine par la mise bas, nécessite des
modifications endocriniennes, fonctionnelles, métaboliques et
morphologiques de l'organisme maternel tant qu'il n' y ait pas des pertes en
cours de gestation.
Paradoxalement, dans l'espèce bovine, la
fréquence des pertes en cours de gestation ou avortements sont
fréquentes et compromettent ainsi toute tentative d'amélioration
génétique bovine. Ces pertes de gestations regroupent les
mortalités embryonnaires, les avortements cliniques dûment
constatés par l'éleveur ou le vétérinaire, les
retours en chaleurs de l'animal ou encore les diagnostics de non- gestation
posés par le vétérinaire
.
| 


