CHAPITRE II: LES MORTALITES EMBRYONNAIRES
La période embryonnaire est classiquement
définie comme la période comprise entre la fécondation et
la fin de l'organogénèse, soit le 42ème jour de
gestation [GAYRARD et al., 2003]. Cette date
considérée comme marquant la fin de la période
embryonnaire est estimée au 45ème jour par
AYALON (1978). Il précise que
plusieurs auteurs incluent dans cette période les échecs de
fécondation au même titre que les échecs après la
fécondation dus surtout à la mortalité embryonnaire.
II.1. Définition
On distingue deux (2) types de mortalité embryonnaire: La
mortalité embryonnaire précoce (MEP) et la
mortalité embryonnaire tardive (MET).
La première ferait référence à la
période pour laquelle on ne dispose d'aucun moyen de diagnostic de
gestation soit environ les 20 premiers jours suivant l'insémination
[HANZEN, 2008a]. Cliniquement, on observe un retour en chaleur
de l'animal 18 à 24 jours après la mise à la reproduction.
La durée normale du cycle n'est donc pas modifiée.
La seconde correspond à une perte embryonnaire ayant
lieu entre le 16ème et le 42ème jour
après l'insémination (Figure 9). Cliniquement,
on constate un retour en chaleurs décalé entre 25 et 35 jours
après l'insémination. En effet, l'embryon a alors eu le temps
d'émettre un signal de maintien du corps jaune, dû à
l'action antilutéolytique de l'IFNô ce qui entraîne un
allongement du cycle sexuel [LEDOUX et al., 2006].

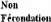
Figure 9: Définition des échecs de
gestation. [Source: DIZIER, 2008]
II.2. Facteurs associés à la mortalité
embryonnaire
De nombreux facteurs sont à l'origine de
mortalité embryonnaire. Certains sont parfois plus impliqués dans
un type de mortalité que dans l'autre. Cependant, il n'est pas possible
de mettre en évidence, à partir des données
collectées en élevage dans les différentes études,
les rôles respectifs des facteurs sur l'absence de fécondation ou
la MEP puisqu'aucun test biologique ne permet de les distinguer. Ces facteurs
peuvent être regroupés dans quatre (4) grandes catégories:
les facteurs gamétiques et embryonnaires, les facteurs parentaux,
facteurs biologiques et les facteurs environnementaux (Tableau
I)
II.2.1. Facteurs gamétiques et embryonnaires
II.2.1.1. Facteurs liés aux gamètes
Le zygote issu de la fécondation est composé de
matériel génétique et non génétique
provenant de l'oocyte et du spermatozoïde. L'oocyte apporte beaucoup plus
de matériel que le spermatozoïde si bien que le cytoplasme du
zygote est largement dérivé de l'oocyte et seules les
mitochondries maternelles (et non celles issues du spermatozoïde) sont
présentes dans le zygote.
Etant donné que le zygote dérive des
gamètes, il n'est pas étonnant que des erreurs dans la formation
ou les fonctions de l'oocyte et spermatozoïde puissent altérer la
survie de l'embryon [SNIJDERS et al., 2000].
~ L'oocyte
De nombreux facteurs altèrent la compétence de
l'oocyte et par conséquent la survie embryonnaire. Ainsi, les rations
composées d'une grande quantité de protéines
dégradables sont responsables d'une diminution de la compétence
qui passe de 23,2% d'oocyte arrivant au stade blastocyste à seulement
8,8% [HANSEN, 2002].
De même, une NEC (note d'état corporel) basse
comprise entre 1,5 et 2,5 ramène ce pourcentage à 3,0% contre
9,9% lorsqu'elle est entre 3,3 et 4 [SNIJDERS et al.,
2000].
La chaleur et la saison affectent aussi la compétence
de l'oocyte [AL KATANANI et al., 2002]. Selon le
même auteur, la chaleur entraîne par exemple une
augmentation du nombre de petits follicules. Pour finir, cette
proportion est de 17,6% pendant l'été contre 26,2% (P<0,001)
en hiver [SNIJDERS et al., 2000].
Ces facteurs altèrent la compétence de l'oocyte
en affectant directement le développement de l'oocyte ou en
empêchant les cellules folliculaires d'accomplir leur rôle. Le
follicule transmettrait des informations à l'oocyte lui permettant
d'acquérir sa compétence. Ainsi, la compétence de l'oocyte
est altérée lors de changements dans la dynamique folliculaire
[HANSEN, 2002].
~ Le rôle du spermatozoïde dans la
mortalité embryonnaire
Le spermatozoïde joue un rôle sur la
fertilité non seulement en modifiant le taux de fécondation mais
aussi en apportant à l'embryon des caractéristiques conditionnant
son aptitude à se développer. Peu de chose sont cependant connues
concernant l'impact du mâle sur la mortalité embryonnaire.
D'après HANZEN et al. (1999a), un sperme de
mauvaise qualité favoriserait la mortalité embryonnaire
précoce.
II.2.1.2. Causes génétiques
V' A l'échelle du gène
La reconnaissance maternelle de la gestation fait intervenir
de nombreuses protéines sécrétées par l'embryon et
la mère respectivement l'INFô et les récepteurs à
l'ocytocine par exemple. Ainsi, certaines altérations des gènes
codant pour l'INFô se traduisent par une synthèse de
protéines insuffisante ou ayant lieu à un stade inadéquat
du développement. Cela pourrait entraîner une mauvaise
reconnaissance maternelle de la gestation et se solder par la mort de l'embryon
[DUCOS, 2003].
Il peut également se produire des mutations naturelles
dont certaines sont responsables de mortalité embryonnaire. Des
gènes léthaux récessifs contribuent aussi à la
mortalité embryonnaire. Dans l'espèce bovine, c'est le cas
notamment de la déficience héréditaire en enzyme
uridine-5-monophosphate (UMP) synthétase, permettant la conversion de
l'acide orotique en UMP, précurseurs des nucléotides
pyrimidiques. Cette anomalie a été décrite principalement
dans la population Holstein Nord Américaine. Environ 2% des Holsteins
des Etats-Unis sont porteuses d'une forme autosomale récessive du
gène [DUCOS, 2003].
V' A l'échelle du chromosome
Dans l'espèce bovine, les anomalies chromosomiques
seraient responsables de 20% des cas de mortalité embryonnaire
[DUCOS, 2003]. Les anomalies de nombre sont rares et non
héréditaires.
Les anomalies de structure sont quant à elles plus
fréquentes. Elles concernent le plus souvent des embryons
âgés de moins de 7 jours et leur fréquence diminue avec
l'âge de l'embryon; c'est la preuve indirecte de leur implication dans la
mortalité embryonnaire permettant l'élimination d'embryons
anormaux.
Elles représenteraient une des causes majeures de
mortalité embryonnaire et foetale. Les remaniements de très loin
les plus fréquents sont les translocations Robertsoniennes ou fusion
centrique.
En effet, les translocations 1/29 et 7/21 sont les principales
décrites dans l'espèce bovine [KING et al.,
1995].
La translocation 1/29 est héritable et commune à
de nombreuses races de bovins mais plus particulièrement aux races Pie
Rouge suédoise, Charolaise et la population Blonde d'Aquitaine en France
[GUSTAVSSON, 1979]. Elle résulte d'une
ségrégation anormale des chromosomes lors de la méiose qui
entraîne la formation d'un chromosome submétacentrique issu de la
fusion de deux chromosomes non homologues acrocentriques (les chromosomes 1 et
29). Elle s'accompagnerait d'une baisse de 5 à 10% [DUCOS,
2003], ou de 3 à 8% [HANZEN, et al., 1999a]
de la fertilité des individus porteurs
hétérozygotes. Les taureaux porteurs de cette translocation sont
responsables d'un taux élevé d'embryons aneuploïdes et par
là même non viables [KAWARSKY et al.,
1996]
Quant à la translocation 7/21, elle
entraîne une réduction de 3 à 8 % de la fertilité
mais se traduit davantage par une mortalité embryonnaire que par une
absence de fécondation [HANADA et al.,
1995].
En pratique, la fécondation in vitro ou les traitements
de superovulation contribuent à augmenter la fréquence des
anomalies chromosomiques chez l'embryon. Ces méthodes favoriseraient la
polyspermie, l'absence d'émission du second globule polaire
[IWASAKI et al., 1992].
Tableau I: Effets de divers facteurs sur le
risque de non-fécondation ou de
mortalité embryonnaire
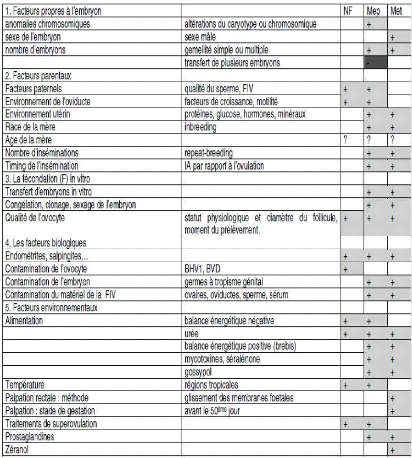
[Source: HANZEN et al.,
1999a]
II.2.1.3. Sexe de l'embryon
Une capacité de développement dépendante
du sexe a été démontrée chez les embryons bovins
produits in vivo et in vitro. Ainsi, les embryons de sexe mâle se
développeraient plus rapidement que ceux de sexe femelle tout au moins
jusqu'au stade de blastocyste [HANZEN et al.,
1999b].
En effet, 95 % des embryons sexés au
7ème jour de gestation se révèlent être
des mâles et ont une meilleure viabilité [AVERY et
al., 1991]. De même, lors de stress consécutif
à la chaleur, le sex ratio sera modifié en faveur du
sexe mâle que la gestation soit gémellaire ou non. RYAN et
al (1993) constatent en effet que, sous un climat chaud
(24-53°C), 54,1% des embryons sexés au 7ème jour
de gestation sont des mâles contre 45,9% des femelles
Etant donné l'absence de différences
significatives du sex-ratio habituellement rapportée à
l'encontre des veaux nouveau-nés, laisse supposer que les embryons de
sexe mâle seraient davantage exposés à une mortalité
embryonnaire ou foetale [BERG et al., 1992; HANZEN et
al., 1999a].
II.2.1.4. Nombres d'embryon
Chez les bovins, la double ovulation s'observe dans 75% des
cas sur le même ovaire. Selon les auteurs, elle s'accompagne ou non, en
cas de gestation, d'un plus grand risque de mortalité embryonnaire.
Cependant, la mortalité embryonnaire est plus souvent observée si
les deux embryons se développent dans la même corne utérine
et davantage encore si la corne droite est concernée [DAY et
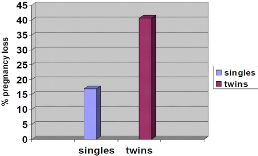
al., 1995]. De même, une étude menée par
ROMANO (2004) montre qu'un grand risque de
mortalité embryonnaire est observé chez les vaches avec une
gestation gémellaire (Figure 10).
Figure 10: Mortalité embryonnaire en
fonction de la taille de la portée. [Source:
ROMANO, 2004]
II.2.2. Facteurs parentaux II.2.2.1. Facteurs
paternels
Diverses publications ont fait état de l'effet
négatif exercé par un sperme de mauvaise qualité sur le
risque de mortalité embryonnaire précoce [DEJARNETTE et
al., 1992; SETCHELL et al., 1988]. De même,
l'influence du taureau sur le développement embryonnaire a
été observée dans diverses expériences de
fécondation in vivo et in vitro [COLEMAN et al., 1987;
SHI et al., 1990].
Le taureau serait sans effet sur la fréquence de la
mortalité embryonnaire tardive évaluée par le taux de
non-retour entre 25 et 35 jours [HUMBLOT et DENIS, 1986] ou
par un suivi progestéronique [BALL, 1978].
| 


