CHAPITRE III
NOTION ET MODALISATION DE LA COMBUSTION
1) Introduction
C'est quoi la combustion ?
Les Phénomènes de combustion se composent de
nombreux processus physiques et chimiques qui présentent un large
spectre d'échelles de longueurs et de temps à déterminer.
Une description mathématique de la combustion n'est toujours triviale,
bien que certaines solutions analytiques des situations simples des flammes
laminaires existent. Ces modèles analytiques sont
généralement limités à des problèmes de
zéro ou une dimension de l'espace.
La combustion est aujourd'hui un des principaux moyens de
conversion de l'énergie. Elle est utilisée dans de nombreux
systèmes pratiques aussi bien pour produire de l'énergie
thermique (chaudières ou fours domestiques et industriels) ou de
l'électricité (centrales thermiques), que pour le transport
(moteurs automobiles et aéronautiques, moteurs fusée, ...) ou
encore la destruction de déchets (incinérateurs). La combustion
peut être caractérisée comme une (ou des)
réaction(s) irréversible(s) fortement exothermique(s) entre un
combustible (ou réducteur) et un comburant (ou oxydant) selon le
schéma global :
Combustible + comburant ? produits de combustion +
énergie thermique
Plus précisément, cette réaction induit
un fort dégagement de chaleur dans une zone très mince (les
épaisseurs typiques de l'ordre de 0,1 à 1 mm) conduisant à
des gradients thermiques très élevés (le rapport des
températures entre réactifs et produits de combustion est
couramment de 6 à 8) et à de larges variations de la masse
volumique ñ. Le taux de réaction raide et fortement non
linéaire (Loi d'Arrhenius en laminaire).
Les combustibles les plus divers, qu'ils soient gazeux,
liquides ou solides peuvent être utilisés :bois, charbon,
hydrocarbures (méthane CH4, propane C3H8 , essence, gasoil,
kérosène, fuel, ...), l'hydrogène (H2)... Le comburant est
le plus souvent l'oxygène de l'air, plus exceptionnellement de
l'oxygène pur (moteur-fusée, certains
fours industriels) qui permet d'atteindre des
températures plus élevées et éviter le stockage
d'azote inerte mais pose des problèmes de sécurité. Plus
rarement, d'autres comburants sont utilisés (moteurs fusée
pyrotechniques) [12].
Deux situations génériques idéales,
schématisée ci-dessous, ont été identifiées,
selon la procédure utilisée pour introduire les réactifs
dans le foyer. Dans les flammes prémélangées
(figure 3.1), les réactifs, combustible et comburant, sont
mélangés avant la zone de réaction. Au contraire, dans les
flammes non- prémélangées ou de diffusion
(figure 3.2), les réactifs sont introduits
séparément, de part et d'autre de la flamme et sont alors
essentiellement entrainés l'un vers l'autre par diffusion
moléculaire.
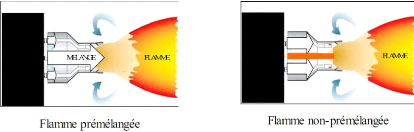
Figure( 3.1) Figure (3.2)

Figure (3.3) : Schéma de la structure d'une flamme
laminaire de prémélangée bidimensionnelle
(gauche)et
d'une flamme de diffusion (droite) [12].
La combustion prémélangée est, a priori,
plus efficace puisque les réactifs sont déjà en contact
avant la combustion. Mais, une telle flamme est susceptible de se propager dans
le mélange combustible/oxydant jusqu'à l'endroit où
s'effectue le mélange, ce qui pose de problèmes de
sécurité. En revanche, si la flamme de diffusion
moléculaire requiert l'apport de réactifs
à la zone de réaction par diffusion moléculaire, elle ne
peut en aucun cas remonter l'écoulement et est donc plus sure. Sa
réalisation pratique est aussi plus simple puisqu'elle ne
nécessite pas un mélange des réactifs dans des proportions
bien définies (c'est-à-dire dans les limites
d'inflammabilité du combustible). Un bruleur non
prémélangée est souvent simplement constitué, par
exemple, d'un injecteur de combustible dans le l'air ambiant ou d'un ou
plusieurs groupes d'injecteurs de comburant(moteur-fusée, fours,...).
Dans la combustion intervenant en milieu gazeux, quatre
situations génériques, résumées sue le figure(3.4),
sont identifiables, selon que l'écoulement est laminaire ou turbulent et
les réactifs prémélangée ou non. En pratique, la
combustion a le plus souvent lieu au sein d'écoulement turbulents
où les transferts sont plus intenses qu'en écoulement
laminaire.
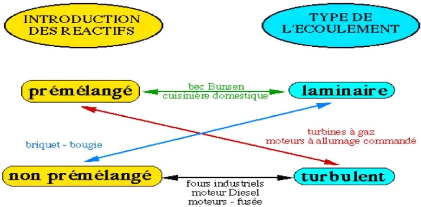
Figure(3.4) : Système pratiques de combustion
classée selon le type d'introduction
des
réactifs(prémélangée ou non) et la nature
laminaire ou turbulente de l'écoulement.
La principale difficulté réside alors dans
l'interaction entre l'écoulement turbulent et le dégagement de
chaleur qui met en jeu une large gamme d'échelles
caractéristiques : échelles spatiales et temporelles de la
turbulence et des réactions chimiques. Les rapports de ces
échelles dépendent d'ailleurs fortement des aspects
étudiés. Ainsi, le temps caractéristique de l'oxydation du
combustible est généralement court comparé aux
échelles des phénomènes turbulents. En revanche, la
formation des
espèces polluantes (oxydes d'azote en particulier) demande
des temps caractéristiques sensiblement plus longs.
L'objectif des recherches en combustion turbulente est
principalement de mieux comprendre les phénomènes complexes qui
entrent en jeu pour pouvoir les modéliser car l'objectif final est la
simulation numérique complète d'un système industriel. En
effet, les coûts de développement d'un prototype, qu'il s'agisse
d'un moteur automobile ou d'un réacteur d'aviation, sont
extrêmement chers. Ils pourraient être sensiblement réduits
en optimisant par simulation numérique un foyer avant de construire un
prototype aussi proche que possible du produit final. Cette optimisation peut
se faire selon différents critères suivant la destination finale
du produit : rendement maximal, moindres émission polluantes, etc....Ils
s'agit aussi d'éviter, ou de contrôler l'appariation
d'instabilités de combustion (couplage entre hydrodynamique de
l'écoulement, dégagement de chaleur et champ acoustique qui
conduit à de fortes oscillations des caractéristiques du
système, augmentant les bruits et les transferts de chaleur et pouvant
conduire à une destruction rapide de l'installation). A l'heure
actuelle, si certaines tendances sont bien reproduites par les calculs, des
simulations numériques vraiment prédictives sont encore loin
d'être disponible.
2) Echelles caractéristique d'une
flamme
Les écoulements prémélangés se
caractérisent par le fait que le combustible et l'oxydant sont
mélangés a une échelle moléculaire. Une
augmentation de la température locale, l'ignition, peut démarrer
le procédé de la combustion si l'écoulement
prémélangé est dans les limites
d'inflammabilité[13]. La combustion se fait sous la forme d'un front de
flamme se propageant dans l'écoulement.
Le temps caractéristique de la chimie et les
échelles de longueurs qui décrivent ces structures sont
déterminées par l'étude de la structure interne d'une
flamme laminaire de prémélangé. La figure 3
représente la structure interne d'une flamme laminaire stationnaire. Les
zones caractéristiques peuvent être identifiées par : la
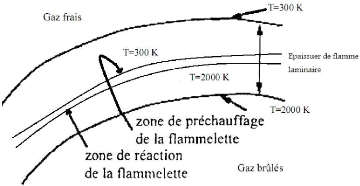
zone de préchauffage, la couche interne et la couche d'oxydation.
La zone de préchauffage est d'épaisseur 0(1),
elle est chimiquement inerte avec un équilibre de la convection et la
diffusion. Dans cette zone les gaz frais qui s'approchent de la flamme avec une
vitesse sont initialement préchauffés.
La couche interne est une zone mince réactive
d'épaisseur 0( ) [14]. Le combustible est consommé dans cette
région avec un équilibre diffusif-réactif. La couche
interne est caractérisée par sa température , qui
correspond à la température de passage entre les réactions
en chaines de branchement et de rupture [15]. Le procédé de
combustion est maintenu si la couche interne demeure intacte. Les
réactions dans la zone interne peuvent s'interrompre si le transport de
chaleur et des radicaux vers l'extérieur dépasse leurs
productions dans la couche interne, ce qui provoque l'extinction de la
flamme.
Dans la couche d'oxydation de taille 0(e), le OO et l'H2
s'oxydent pour former le OO2 et l'H2O. Oes réactions sont d'une
importance mineure par rapport aux caractéristiques de la flamme.
Les échelles caractéristiques de longueur
peuvent être identifiées dans la structure de la flamme laminaire.
L'épaisseur de la flamme laminaire F est approximée
par la taille de la zone de préchauffage définie par [1] :
|
|
( p/ )
( ) (3.1)
|
|
F (O O / )
|
OU est la conductivité thermique, Op la chaleur
spécifique à pression constante, la densité et la vitesse
de la flamme laminaire qui décrit la vitesse à laquelle le front
de flamme prémélangée se propage dans la direction normale
dans le mélange frais(une propriété thermochimique).
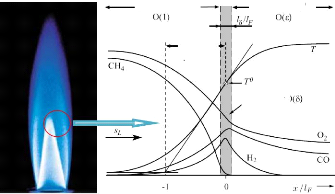
Zone de préchauffage Couche d'oxydation
Epaisseur de
Couche interne
Figure(3.5) : structure interne d'une flamme laminaire
stationnaire de méthane-air
3) Combustion laminaire
On considère les flammes en milieu laminaire, c'est
à dire en milieu où les échanges par diffusion turbulente
sont pratiquement inexistants. Si les flammes laminaires semblent n'intervenir
que dans quelques applications plutôt anecdotiques (bougies et flamme de
briquet) la compréhension de la structure de ces flammes est cependant
fondamentale pour la description et la modélisation de nombreuses
situations industrielles.
3.1) Flamme laminaire
prémélangée
Le combustible et le comburant sont mélangés
à l'avance, la propagation de la flamme est le résultat d'une
opération composée de deux phénomènes :
· Un préchauffage qui se fait sur une
épaisseur äp où les réactions chimiques sont
inexistantes et où les phénomènes convectifs et diffusion
de masse et de chaleur sont prépondérants.
(Gaz frais)
Préchauffage
Zone de
La zone de la réaction
är
Gazes brulés
Figure (3.6) : schéma d'une flamme laminaire
prémélangée
· Arrivant à un certain niveau de
température, les gaz réagissent en dégageant de la
chaleur, c'est la zone de réaction qui se déroule sur une
épaisseur är. Cet échauffement se fait sur une
épaisseur äL qu'on appelle épaisseur de la flamme laminaire
et qui peut être assimilée à la distance parcourue par la
chaleur libérée
par réaction pendant le temps ôc
que dure cette réaction. Ainsi, en faisant intervenir le coefficient de
diffusion thermique D.
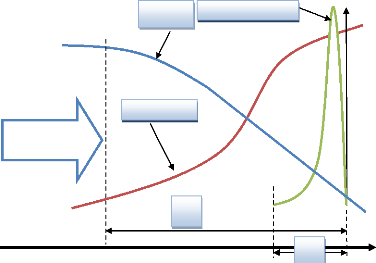
Vitesse des gazes
Température
Réactifs
äL
Taux de réaction
är
Figure (3.7) : Structure d'une flamme laminaire
prémélangée
L'épaisseur de la flamme est exprimée par [8] :
( ) (3.2)
Ces zones se déplacent dans le milieu à une
vitesse de propagation perpendiculaire au front de flamme que l'on appelle
vitesse de flamme laminaire et que l'on note UL. Cette vitesse
dépend de différents paramètres (nature des
réactifs, richesse des mélanges et température des gaz
frais) est de l'ordre de 0.1 à 1 m/s [17].On peut dire que le front de
la flamme progresse pendent le temp de combustion (reaction)
. Sa vitesse est de la forme :

( ..) (3.3)
~
La relation entre la température et le coefficient
d'équilibre est donnée comme suite :
(- ) (3.4)
Ou bien comme :
~
(- ) (3.5)
Tel que les coefficients A B C D E et F sont des constants
tabulés.[18]
3.2) Flamme laminaire non
prémélangée
La caractéristique principale de la flamme non
prémélangée, dite de diffusion, consiste en une zone de
réaction séparant les réactifs (combustible et oxydant).
Les profils des fractions massiques et de température sont
présentés sur la figure suivante :
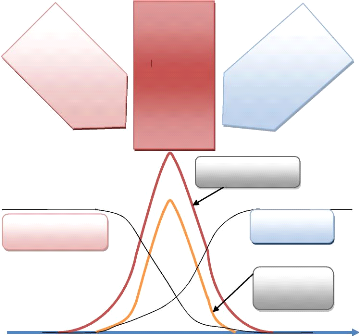
COMBUSTIBLE
Combustible
La flamme
TEMPERATURE
OXYDANT
TAUX DE REACTION
Oxydant
Figure (3.8) Profile d'une flamme laminaire non
prémélangée
Comme les flammes de prémélangé, les
flammes de diffusion se développent grâce au concours des
phénomènes de réaction ainsi que des
phénomènes de diffusion de chaleur et de masse qui se produisent
de part et d'autre de la zone réactive.
Le phénomène de convection joue cependant un
rôle plus important en amenant les réactifs et en emportant les
produits de façon plus efficace que la diffusion seule. Pour que la
flamme reste laminaire, il faut que les vitesses d'écoulement ne soient
pas trop grandes. Le taux de réaction de ce type de flammes est
principalement contrôlé par diffusion moléculaire qui
gouverne l'apport des réactifs vers les flammes.
Considérons la réaction chimique entre le
combustible F et l'oxydant O : F s ( s)F (3.6)
Où s désigne le coefficient
stoechiométrique massique.
En terme de fraction massique cette réaction devient :
F F p (3.7)
YF,YO, YP désignent les fractions massiques et les
coefficients stoechiométriques
molaires de la réaction.
Les équations de transports des fractions massiques sont
;
a
a
a
a
a
a
_ p ( F F) ? F (3.8)
( ) ? (3.9)
( ~ ) F? ( ) (3.10)
p
Où la diffusion moléculaire des espèces est
décrite par la loi de Fick.
Q est la quantité de chaleur libérée par la
combustion d'une unité de masse de combustible.
Une nouvelle grandeur nommée fraction de mélange Z
(variable de Schwab-Zeldovich) est définit par :
(
) (
) (3.11)
F est la fraction massique de Fuel dans l'écoulement
(cette fraction massique peut être inférieure à
l'unité si le combustible est dilué) [18].
Et est celle de loxydant (typiquement dans l'air est égale
à 0.23).
Si on suppose que les coefficients de la diffusivité
massiques du combustible et
comburant sont égaux (DF = DO=D) alors la grandeur Z sera
un scalaire passif qui suit une équation de convection-diffusion sans
terme source :
a a a
a a a
( a
a ) (3.12)
Les propriétés de ce scalaire passif sont
très intéressantes sont ;
· Z=1 dans le combustible.
· Z=0 dans le comburant.
· Z(x,t) represente le degré du mélenge de
combustible dans le comburant. Sous l'hypothèse de la chimie infiniment
rapide (c à d l'oxydant et le combustible ne coexistent jamais sans
réagir), le front de la flamme est définit par la relation
~ correspondant à l'iso-surface
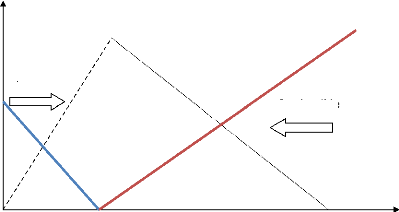
vi
T
Oxydant
Combustible
0 Zst 1
Figure(3.9) Fractions massiques réduites du
mélange en fonction de Z dans le cas de la chimie infiniment
rapide(
solution de Burke et Schumann)
On peut réécrire les équations des
fractions massiques et de la température dans un nouveau système,
où elles sont exprimées en fonction de la fraction de
mélange uniquement.
On supposant que les effets instationnaires sont
négligeables, ce qui donne :
2 ( ) (3.14)
Or est la dissipation scalaire de Z.
Dans le cas de la chimie infiniment rapide (hypothèse
de Bruke et Schumann) le taux de réaction ? est nul en dehors de la zone
de la reaction definie par Z=Zst . Dans ce cas les
fractions massiques et la température sont alors affines par morceaux.
(Voir la figure(3.9).
4) La combustion turbulente
Dans un foyer, l'écoulement est turbulent,
c'est-à-dire que la vitesse des gaz, mesurée en un point, fluctue
continument de façon apparemment aléatoire, même en
régime parfaitement établi; cela est vrai aussi pour la
température et toute autre caractéristique du milieu. Cette
turbulence est due à une forte vitesse de l'écoulement entrant ;
elle s'est développée dans le canal amont à cause des
gradients de vitesse aux parois et à partir d'obstacles tels que les
injecteurs. Le taux de dégagement de chaleur et la structure de la
flamme, varient selon des temps caractéristiques, qui sont souvent le
temps de la réaction chimique ôc et le temps
de fluctuation de l'écoulement ôt.
4.1) La combustion turbulente
prémélangée
Dans la combustion turbulente prémélangée
les structures de la turbulence influent le front de la flamme qui peut avoir
une vitesse d'ordre de (10 m/s) et d'une épaisseur de (1 mm) jusqu'au
(1m). Cette interaction peut produire une augmentation de la consommation de la
masse et une augmentation de l'épaisseur globale de la flamme.
4.1.1r1ll11f14EF la turbulence sur les
flammes
Damkohler en (1940) est le premier qui a décrit la
combustion turbulente et a introduit le principe de rides comme le principal
mécanisme qui contrôle les flammes turbulentes.
Dans une combustion turbulente, ST est la vitesse
à l'entrée du volume nécessaire pour maintenir la
combustion turbulente stationnaire, cette vitesse est dite vitesse de la flamme
turbulente.
4.1. Erif lgniViliM
On a vu que dans un écoulement turbulent
réactif, la combustion dépend de la turbulence, aussi la
combustion a une influence sur la turbulence. Quand la température passe
du front de flamme vers celle des gaz frais, la viscosité et le nombre
de Reynolds local sont modifiés en conséquence.
Par exemple, pour l'air la viscosité est proportionnelle
á T1.7, pour une flamme
avec taux de température de le nombre de Reynolds est 40
fois plus petit dans les
gaz brulés. C'est pourquoi on observe le
phénomène de relaminarisation (après l'allumage
l'écoulement turbulent peut devenir laminaire) [18].
4.2) Classification des flammes
La classification de la combustion turbulente
prémélangée peut être faite si on
observe
l'interaction entre le front de flamme (épaisseur et vitesse
SL) et l'ensemble des
tourbillons (échelles
intégrales lt jusqu'aux tourbillons de Kolmogorov avec la
taille
) où :
(
~ ~ ) (3.15)
Et de la vitesse de Kolmogorov á la
vitesse intégrale [8].
La relation entre le rapport de l'échelle intégrale
lt et la longueur de Kolmogorov est donné par
Si on suppose que la turbulence est homogène et isotrope
alors la vitesse u'(r) s'exprime par :
( ( ))
£ (3.17)
Ou r désigne la taille des tourbillons.
Le temps turbulent typique pour un tourbillon de taille
r
( )
( ) ~ (3.18)
On compare avec l'échelle de temps d'une flamme (chimique)
telque
/ (3.19)
On introduire le nombre de Damköhler Da qui
caractérise le temps de la turbulence par rapport au temps de la
chimie
Da(r) change lorsque r varie de la taille de
Kolmogorov vers l'échelle integralle lt.
A quelle valeur de r peut on contrôler la
structure de la flamme ?
Les approches classiques introduisent deux nombres correspondant
pour limiter la valeur de r :
. Le nombre de Damköler definit pour les
grands tourbillons et correpondantà
l'échelle integrale de temps t/ ( D et à
l'échelle de temps chimique ;
li
1
a
c
/ (/ ) (3.21)
/
Le nombre de Karlowitz Ka correspondant aux petits
tourbillons, donc c'est le rapport de l'échelle de temps chimique et du
temps de Kolmogorov ;
a c
~
a( ) m( )
( ) / (3.22)
/
Ce nombre peut s'exprimer comme suit

~
~ (~ ( v~ /
) ) ( ) / (3.23)
Le nombre de Reynolds turbulent basée sur l'échelle
intégrale s'écrit:
I ( ) (~ ) (3.24)
Ou bien :
a a (3.25)
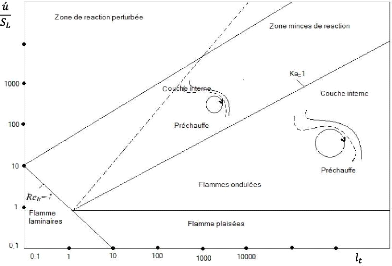
5) Diagramme de la combustion turbulente
prémélangée
On peut distinguer plusieurs types de flammes turbulentes
prémélangées suivant la valeur des deux nombres
caractéristiques
et ~
, et sont la vitesse et longueur
caractéristiques de la turbulence qui règnent
dans la flamme au point considéré, et est la vitesse, est
l'épaisseur d'une flamme laminaire[19]. Trois droites divise le
diagramme de Borghi (Borghi 1984, Candel et Al 1994, Poinsot et Al 1991) en
quatre domaines chacun a un comportement spécial. La première
droite est pour le nombre de Reynolds turbulent égal a 1, la
deuxième correspond au critère de Kilmov-Wiliams KW, qui
égalise entre le temps global de la réaction et le temps de
Kolmogorov , et la troisième est pour un nombre de Damkohler
a=1. Pour bien éclairer cette opération, on va
définir les différents paramètres utilisés
au-dessus dans le tableau suivant :
|
Echelle de
|
Flamme
|
Turbulence
|
|
|
Nombre
|
|
Temps
|
Temps global de la
réaction
|
Temps de Kolmogorov Temps intégral
6
|
/
(V ~)
|
a
--
|
|
Longueur
|
L'épaisseur de la flamme laminaire
|
L'échelle intégrale L'échelle
intégrale de
Kolmogorov (v ~
|
|
/
|
|
|
4 /
)
|
6
|
Tableau(3.1) : échelles temporelles et spatiales pour les
flammes turbulentes prémélangées
D'après le diagramme de combustion on peut remarquer qu'on
a quatre régimes :
Régime1: , dit régime des
flammes plissées, les fluctuations turbulentes
sont
très petites devant la vitesse de propagation laminaire de
la flamme >> . C'est à
dire que les déformations du front de flamme à
cause des tourbillons sont détruites par la propagation du front de
flamme, donc la turbulence ne produit aucun effet sur la flamme qui reste
laminaire, seulement des petits plissements peuvent être observés.
Ce régime est nécessaire pour l'amélioration du
procédé de combustion.
Figure(3.10) :regime1 de combustion
Régime 2 : Ce régime est
limité par et par , il est divisé aussi en deux
sous régimes, le première au-dessous de
~ , le front de flamme laminaire est
affecté par les contraintes de la turbulence dont
l'échelle spatial de Kolmogorov est
très grande devant , cela veut dire que la rotation des
tourbillons de grandes échelles est supérieure à la
vitesse de la flamme laminaire, ondulant aussi le front de la flamme. Seulement
le front de flamme est déformé sans être
déchiré, par contre le rapport U > , les plissements va se
déformer de plus en plus, c'est le régime des flammes
ondulées. Les deux régimes 1 et 2, sont dit les
régimes des flammelettes.
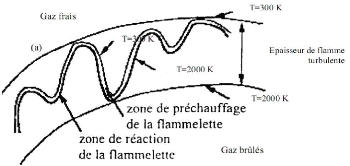
Figure(3.11) :regime2 de combustion
Régime3 : Ce régime est dit
régime de la zone de réaction,
limité par K - W = 1 et par la droite Da = 1,
l'échelle de Kolmogorov 11k est donc petite devant l'épaisseur de
la flamme laminaire SL et T > Tk.Dans ce cas les contraintes dues aux
petites structures de la turbulence peuvent influencer la structure interne du
front de flamme instantané et donner lieu a son étirement qui
peut modifier son épaisseur et sa vitesse de propagation laminaire.
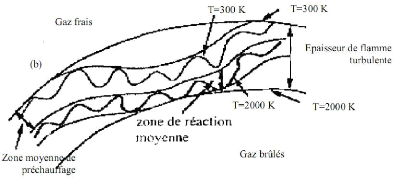
Figure(3.12) :regime3 de combustion
Régime4 : Ce régime est
appelé régime de la zone perturbée,
c'est l'expansion du régime précédent, il se
caractérise par un nombre de Damkohler inferieur à 1. Dans ce
régime aucun plissement de flamme ne peut exister, on parle seulement de
la zone de réaction que de flamme avec une épaisseur
définie. En d'autres termes, les plus petits
tourbillons pénètrent dans la couche interne,
provoquant des ruptures locales des réactions chimiques dues à la
perte de chaleur en direction de la zone de préchauffage et induisant
une diminution de la température et une perte des radicaux.
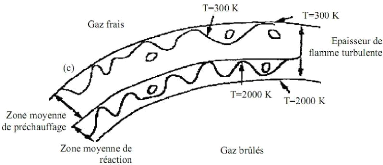
Figure(3.13) :regime4 de combustion

Figure (3.14) :Diagramme de régimes de la combustion
6) Modélisation de la combustion
turbulente
Pour maitriser et optimiser la combustion turbulente, il faut
comprendre les mécanises qui intervient dans ce phénomène
et les interactions entre la turbulence et les flammes. Pour cela deux voies
sont possibles, celle expérimente qui reste très couteuse, non
accessible et limitée surtout dans l'espace. L'autre alternative est le
calcul numérique par l'intermédiaire de la modélisation de
la combustion turbulente. Dans ce cas et suivant l'échelle de temps et
de l'espace de la combustion et de la turbulence, on peu se situer d'une
façon grossière sur le diagramme de combustion, cela va permettre
de connaitre le type de flamme qui va être modélisée.
Les mesures de l'expérience utilisée dans notre
travail [1],[2] montrent que l'échelle de temps de la réaction
est très court par rapport à celui de la turbulence, aussi les
fluctuations turbulentes et la vitesse de la flamme laminaire sont comparable.
Ceci dit, la combustion se passe dans le régime des flammelettes ou un
découplage de la chimie du champs dynamique turbulent est possible.
Parmi les modèles les plus simples et les plus utilisé dans ce
type de flammes, l' EDM (Eddy dissipation Model).
6.1) Modèle Eddy Break Up
Ce modèle est basé sur une analyse
phénoménologique de la combustion turbulente aux grands nombres
de Reynolds (Re>> 1) et de Damkhöler (Da >> 1). Suivant la
cascade de Kolmogorov, la turbulence provoque la cassure des tourbillons des
gaz frais. Une des premières approches modélisant le terme source
chimique moyen est proposé par Spalding[20]. Il suppose que le
mélange turbulent contrôle le taux de réaction chimique. En
prenant une reaction chimique irréversible à un pas:
R (réactifs) P (produits)
Le taux de réaction moyen est donné pour les
produits par :
~~ U Þ ~Þ ( Þ~ ) (3.26)
Avec Þ~ la variance de la fraction massique des produits et
U une constante libre de
modélisation.
Plus tard, ce modèle est amélioré par
Magnussen et Hjertager [11], donnant ainsi
le modèle EDM (Eddy
Dissipation Model). Dans ce dernier, la variance est
substituée par la fraction massique de l'espèce en
déficit. D'où, le terme source moyen est calculé par :
~ Þ~ Þ n ( Þ~ Þ' Þ~
) (3.27)
Où A et B sont des constantes de modèle et est le
coefficient stoechiométrique donné par :
M
M
íO est le coefficient stoechiométrique de
l'oxygène et íF est le coefficient
stoechiométrique du fuel.
En plus, les termes de transport turbulent pour les scalaires
réactifs sont modélisés par l'approximation en gradient.
Dans les deux modèles l'échelle de temps chimique est
remplacée par celle du temps turbulent, représentant la chimie
infiniment rapide seulement. Il faut noter que les constantes des deux
modèles sont libres. Elles sont déterminées par
optimisation pour chaque combustible et pour chaque géométrie.
Ces modèles sont largement utilisés dans les codes, surtout pour
démarrer d'autres modèles plus compliqués, à cause
de leurs implémentations très simples et leurs coûts en
calcul négligeable.
6.2) Modèle EDM dans le code FLUENT
Le modèle EDM est intégré dans le code
fluent, le taux de production d'une réaction élémentaire
k, est déterminé par le minimum des deux expressions
suivantes : Limiteur des réactifs
E
V
V
~ (
~ ~ ) (3.28)
V
Limiteur des produits
E ? p p (3.29)
? v
~! M
Avec , est la fraction massique des produits et la fraction
massique du réactif R, A et B sont des constantes qui prennent pour
valeurs 4 et 0.5.
7) Variable d'avancement de la
réaction
L'avancement de la réaction ou de la flamme est le
résultat d'un grand nombre de réactions chimiques
élémentaires. Pour l'hydrocarbure le plus simple, une dizaine
d'espèces intermédiaires et une centaine de réactions
chimiques sont nécessaires. Cependant, il faut noter que peu de
réactions influent le procédé général. Par
conséquent, l'avancement chimique peut être
représenté par peu de variables et dans le cas le plus simple par
une variable d'avancement de la réaction c. Cette variable doit
être normalisée et varie entre zéro (pour le mélange
frais) et un (pour le gaz brûlé) figure suivante :
Gaz frais Gaz brûlés
Font de flamme
Figure(3.15) : Définition de la variable d'avancement
Dans les systèmes adiabatiques fermés, la
température varie d'une manière monotone en fonction du
procédé chimique. Dans ce cas, une fonction de la
température normalisée peut définir la variable
d'avancement de la réaction c :
( ~ )
( ~ ) (3.30)
Où T représente la température
locale effective, Tf la température des gaz frais et
Tb la température adiabatique des gaz complètement
brûlés.
La variable d'avancement peut être également
basée sur une fraction normalisée d'une espèce des
réactifs ou de produit stable de la combustion. Par exemple, Ferreira
[11].utilisa la définition suivante :
( -- )
( -- ) (3.31)
Avec YF est la fraction massique réelle locale du
combustible, YF, f et YF, b représentent
respectivement les fractions massiques dans les conditions fraîches et
brûlées.
| 


