V.3. CHROMATOGRAPHIE SUR COUCHE MINCE (CCM)
V.3.1. Introduction
Le botaniste russe MIKHAEL TSWETT est
considéré comme le père de la chromatographie. En effet,
c'est lui qui a utilisé pour la première fois la chromatographie
pour séparer et isoler les pigments végétaux entre autre
les chlorophylles et xanthophylles en se servant d'une colonne à base
de craie pulvérisée ou carbonate de calcium (CaCO3).
C'est une chromatographie d'adsorption. (15)
La chromatographie selon Ergon STAHL, est une
technique physico-chimique pour la séparation des mélanges des
substances basées sur les différents temps de rétention
des substances individuelles dans les phases stationnaire et mobile
primitivement limitées aux substances colorées. (16) p.29
La chromatographie est la méthode de séparation
la plus souple et la plus efficace qui puisse se présenter aux chimistes
(analystes). (15)
V.3.2. Définition et Principe
Définition
La Chromatographie sur Couche Mince (CCM) selon Ergon
STAHL, est une méthode de séparation physico-chimique. La couche
mince (phase stationnaire), constituée d'une substance finement
pulvérisée, est appliquée ou fixée sur une plaque
de verre, de métal ou sur une feuille appropriée. La solution du
mélange inconnue est déposée à la ligne de
départ sous forme d'un point. La plaque ou la feuille est introduite
dans une cuve étanche contenant l'éluant approprié (phase
mobile). (16) p.13 et 14
La phase mobile ou éluant est un moyen de transport,
qui est constituée d'un ou plusieurs solvants. Elle monte par
capillarité dans la phase stationnaire, c'est-à-dire la couche
poreuse. (16) p.17
La CCM est particulièrement indiquée pour la
recherche analytique des en pharmacie. (16) p.13
Principe
La séparation des constituants du mélange
s'effectue grâce à l'ascension par la phase stationnaire
(développement). Ensuite, les substances incolores seront rendues
visibles (détection). (16) p.13 et 14
Selon la nature des phases stationnaires la séparation
des substances en CCM se fait en fonction les phénomènes
suivants :
v Phénomène Adsorption sur phase stationnaire
imprégnée sur un support (Chromatographie d'adsorption)
v Phénomène de Partage entre une phase
stationnaire imprégnée sur un support (Chromatographie de
partage)
v Phénomène d'Echange d'ions (Chromatographie
d'échange d'ions)
v Phénomène d'exclusion stérique
(Chromatographie d'exclusion stérique) (15)
V.3.3. Choix du système
En chromatographie, au moins trois éléments
interviennent dans le choix du système chromatographique. Il s'agit de
la phase stationnaire, la phase mobile et le mélange de substances
à séparer. (15)
Le choix de la méthode chromatographique sur couche
mince (adsorption, partage et échange d'ions) est
déterminé par la nature de la phase stationnaire utilisée.
La phase mobile est choisie en fonction de l'activité de la phase
stationnaire et de l'affinité de celle-ci vis-à-vis des
substances à séparer. (15)
Cette affinité résulte des
caractéristiques structurales les plus importantes, en particulier des
différences de structure des substances à étudier.
L'influence des dimensions de la molécule est plus faible dans la
méthode par adsorption que dans celle de partage où les
différences de solubilité, dépendant de la grandeur de la
molécule se manifestent très nettement. (15)
En CCM, plusieurs séries d'éluants sont
essayées avant de procéder à un changement de phase
stationnaire. Souvent deux substances non séparées par un
éluant, le sont par le voisin immédiat dans la série
éluotrope. (15)
Cependant, l'utilisation de mélanges trop complexes
peut nuire à la reproductibilité des valeurs de rapport frontal,
à cause des modifications de la composition de l'éluant des dues
à des volatilités différentes des solvants
utilisées. (15)
V.3.4. Chromatographie sur couche mince
d'adsorption
a) Choix de la phase stationnaire
En chromatographie d'adsorption, presque tous les oxydes et
oxydes hydratés employés comme phase stationnaire. Les substances
adsorbées sont des composés polarisables, elles sont maintenues
à la surface de l'adsorbant par des forces électrostatiques et
des liaisons hydrogènes qu'elles forment avec les oxydes
hydratés. La polarisation extrême peut conduire à
l'ionisation de la molécule adsorbée. (15)
L'activité des adsorbants usuels est très
variable, elle peut d'ailleurs être modifiée suite à
certains facteurs en particulier la teneur en eau. Cette dernière est
d'une grande importance dans l'activité d'un adsorbant car les
molécules d'eau sont très polaires, facilement adsorbées
et bloquent la surface des sites de l'adsorbant. (15)
Les adsorbants les plus communs sont : le gel de silice
et l'albumine sous forme oxydé. (15)
L'alumine est surtout utilisée pour la
séparation des mélanges basiques (alcaloïdes par exemple),
les stéroïdes, les hydrocarbures à haut poids
moléculaire, les terpènes et les glycérides de bas poids
moléculaire. (15)
Le gel de silice est la phase stationnaire la plus importante
et la plus utilisée. Il en existe de différentes sortes suivant
qu'il contient ou non un agent liant ou un indicateur de fluorescence. (15)
Chimiquement, le gel de silice est constitué
d'anhydride polysilicique sous forme de grains durs et poreux. Il est
particulièrement adapté à la chromatographie des
substances polaires par suite de la possibilité pour ces
dernières de former des liaisons hydrogènes avec les hydroxyles
attachés au squelette silicié. (15)
Borke et Kirsh ont
été les premiers à utiliser n gel formé de silice,
d'oxyde de magnésium et de sulfate calcium dans les proportions
(10/10/4) et imprégné d'une solution tampon de
déhydrogénophosphate de potassium de pH en 1953. (15)
b) Choix de la phase mobile
Le choix de la phase mobile (qui est un solvant ou un
mélange de solvants) dépend avant tout de la polarité des
constituants de l'échantillon et de phase stationnaire. Ces deux phases
doivent avoir des polarités opposées. (15)
V.3.5. Rapport frontal et avantages de la CCM
Le rapport frontal (Rf) exprime le rapport entre la distance
parcourue la substance et la distance parcourue par le front de la phase
mobile. Ces distances sont mesurées à partir de la ligne de
départ correspondant au centre de dépôt initial du
mélange à séparer jusqu'au centre du ou des spot(s) et au
front du solvant. Il faut noter que chaque substance possède un Rf dans
un système chromatographique donné. (15)
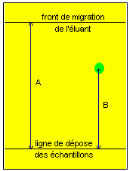
Distance
parcourue par la substance (B)
Rf=-----------------------------------------------------------
Distance parcourue par le front du solvant
(A)
La CCM présent les avantages ci-après :
- la rapidité d'exécution (1 à 2 heures),
- la simplicité d'exécution,
- un coût modeste,
- la sensibilité de l'ordre des microgrammes (ug).
V.3.6. Application de la CCM en Pharmacie
Dans le domaine pharmaceutique, le principal
intérêt de la chromatographie en couche mince est de permettre la
détermination, de faibles concentrations d'impuretés dans les
substances médicinales. Lorsqu'on l'utilise à des fins
d'identification, cette technique permet de comparer le comportement
chromatographique de la substance à identifier avec celui d'une
substance étalon qui est généralement un spécimen
authentique du produit à examiner. (15)
Grâce à la grande variété des
couches que l'on utilise en association avec divers solvants, on peut faire
varier le pouvoir séparateur d'une manière presque infinie et
c'est ce qui rend la CCM aussi utile en Pharmacie. (15)
Pour ce qui est des déterminations quantitatives, elles
peuvent être effectuées directement sur la plaque soit
après récupération du produit sur la plaque en grattant la
tâche et en utilisant un solvant approprié pour l'extraire de
l'adsorbant. Après récupération, le dosage peut se faire
par une méthode suffisamment sensible telle que la
spectrophotométrie UV/Visible, soit directement, soit après
dérivatisation ou réaction chimique (méthode de
Green). (15)
V.4. SPECTROPHOTOMETRIE UV/VISIBLE
La spectroscopie d'absorption moléculaire dans
ultraviolet, le visible et l'infrarouge est largement utilisée pour
l'identification et le dosage d'innombrables espèces inorganiques et
organiques. La spectroscopie d'absorption ultraviolet-visible est surtout
employée en analyse quantitative et est probablement plus
utilisée que toutes les autres méthodes dans les laboratoires
d'analyses chimiques ou médicinales du monde entier. (15)
V.4.1. Absorption par les composés
organiques
L'absorption de rayonnement par les molécules
organiques dans le domaine de longueurs d'onde compris entre 180 et 780 nm
(nanomètre) résulte des interactions des photons qui participent
directement à la formation de la liaison `et qui sont donc
associés à plus d'un atome) avec ceux qui sont localisés
sur des atomes tels que l'oxygène, le soufre, l'azote et les
halogénures. (15)
Les longueurs d'onde d'absorption d'une molécule
organique dépendent de l'énergie de liaison de ses
différents électrons. Les électrons qui forment des
liaisons simples carbone-carbone ou carbone-hydrogène absorbent à
des longueurs d'onde au dessous de 180 nm (l'ultraviolet lointain) et ceux
compliqués dans les doubles ou triples liaisons absorbent à des
longueurs d'onde au dessus de 181 nm jusqu'à 780 nm (l'ultraviolet
proche et le visible). (15)
Les groupements fonctionnels organiques insaturés qui
absorbent dans l'ultraviolet et le visible sont appelés des
chromophores. (15)
V.4.2. Avantages
La spectroscopie d'absorption ultraviolet-visible
présente les avantages ci-après :
- un vaste champ d'application,
- une grande sensibilité,
- une grande sélectivité,
- une bonne exactitude,
- une facilité de mise en oeuvre. (15)
V.4.3. Applications qualitatives et quantitatives
Pour les applications qualitatives, la
spectrophotométrie dans l'ultraviolet détecte les groupements
chromophores ou des atomes tels que le soufre ou les halogénés
par l'apparition d'un ou plusieurs pics dans le domaine de 200 à 400 nm.
Les spectres dans l'ultraviolet ne présentent cependant pas de
structures suffisamment fines pour permettre l'identification certaine d'un
analyste, mis ils doivent être complétés par d'autres
données physiques ou chimiques fournies par d'autres méthodes
spectroscopiques. (15)
Pour les applications qualitatives, la spectroscopie
d'absorption dans l'ultraviolet et le visible est un des outils les plus
utilisés par les chimistes et les biologistes en analyse quantitative.
(15)
Deuxième Partie :
PARTIE EXPERIMENTALE
INTRODUCTION
Le présent travail vise l'évaluation de la
stabilité chimique de l'Artésunate contenu dans les
comprimés en co- blister avec ceux de l'Amodiaquine dans la
spécialité ARSUCAM® provenant des sources
pré qualifiées.
Cette évaluation a été effectué
grâce aux tests d'identification de l'Artésunate tels que la
Chromatographie par Couche Mince, la recherche des produits de
dégradation et l'évaluation pharmaco techniques des
comprimés.
Les résultats obtenus sont rendus et
discutés.
CHAPITRE I. MATERIEL ET METHODES
I.1. Echantillons
Trois échantillons de trois lots différents
d'une même spécialité ARSUCAM®
collectés après la péremption des sources
préqualifiées (centrales de distribution régionale de
Kisantu).
Le tableau I donne les détails relatifs à ces
échantillons.
Tableau I : Caractéristiques des
échantillons d'Artésunate-Amodiaquine
collectés
|
N°
|
Dénomination
|
N° de Lot
|
Date de fabrication et de péremption
|
Codification
|
|
1
|
ARSUCAM® (7 à 13
ans)
|
081
|
03/2005 et 03/2007
|
KIS/AS-AQ/07/01
|
|
2
|
ARSUCAM® (7 à 13
ans)
|
086
|
03/2005 et 03/2007
|
KIS/AS-AQ/07/02
|
|
3
|
ARSUCAM® (7 à 13
ans)
|
075
|
03/2005 et 03/2007
|
KIS/AS-AQ/07/03
|
I.2. Matériel et réactifs
Le matériel et les réactifs suivants ont
été utilisés pour notre étude :
- Capsule en porcelaine
- Balance analytique Mettler H20
- Erlenmeyers 25 ml, 50 ml, 100 ml, 250 ml, 500 ml, 1000
ml,
- Pipettes 5 ml, 10 ml, 25 ml
- Tubes à essai
- Pieds gradués 50 ml, 100 ml
- Pilon et mortier
- Plaque chauffante
- Entonnoir
- Béchers 25 ml, 50 ml et 100 ml
- Chambre (cuve) chromatographique (Boite de Mayonnaise)
- Microcapillaires 2ul et 1ul
- Papier filtre « VWROME »130, 413, 90
nm
- Capsules en verre
- Pince
- Spatule
- Pissette 100 ml
- Phase stationnaire : Plaque CCM Sil G-25 UV254 (Gel de
silice 60 F254)
- Phase mobile : Toluène/Acétate
d'éthyle/Ethanol (6/3/1)
- Méthanol
- Ethanol
- Toluène
- Acétate d'éthyle
- Vanilline/Ethanol/H2SO4
- Eau distillée
- Poudre d'Artésunate (matière première)
I.3. Détermination du poids moyen et des
variations de poids des comprimés
Principe
La détermination du poids moyen des comprimés se
fait en prélevant 20 comprimés au hasard dans un même lot
et les peser un à un au moyen d'une balance à précision. A
l'aide de la formule ci-dessous, on calcule le poids moyen et les variations de
poids.
?Pi
Poids Moyen (PM)= ------
20
Poids minimal-Poids moyen
Ecart (-) = ---------------------------------------x100
Poids moyen
| 


