3.4- Préparation des précultures
Ces souches ont été identifiées aux
laboratoires et, utilisées comme souches de références
pour des études préliminaires de sensibilité
vis-à-vis des différentes H.E. Les différentes souches
bactériennes ont été repiquées dans des tubes de
gélose de conservation (en piqûre centrale) puis incubées
à 37#177;1 °C. Après 24 h d'incubation, ces tubes sont
conservés à la T° de réfrigération (2#177;1
°C). Dans le but de garder toujours la disponibilité en souches,
chaque 15 jours, des opérations de repiquage sont
réalisées.
Avant la réalisation des tests antibactériens,
deux repiquages consécutifs sont effectués pour chaque souche
(cf. figure 21): en premier lieu, elles ont été inoculées
dans de BHIB liquide et incubées pendant 24 h à 37#177;1 °C.
Le deuxième repiquage est effectué sur milieu solide
(gélose nutritive) la veille de la réalisation du test
antibactérien. L'ensemble a été incubé à
37#177;1 °C pendant 18 h pour avoir des cellules bactériennes
à leur phase exponentielle de croissance. À partir de cette
culture bactérienne fraîche, on prélève quelques
colonies que l'on mélange avec de l'eau physiologique stérile.
Pour la standardisation de la charge de l'inoculum de départ, la
méthode de comparaison de la densité bactérienne à
celle d'un tube de référence (0,5) Mc Farland dont la charge est
supposée être 105 ufc/mL a été
employée.
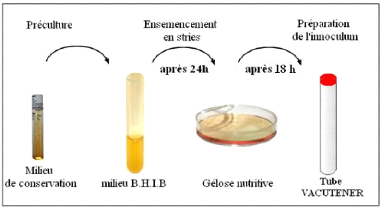
Fig. 21: Préparation de l'inoculum.
3.5- Tests antimicrobiens 'in vitro'
Trois méthodes ont été retenues pour tester
l'effet antimicrobien des H.E.: - Méthode de diffusion sur disques
(aromatogrammes) ;
- méthode de diffusion en puits ;
- méthode de microatmosphère.
Il est à noter que ces tests sont réalisés
en duplicata.
3.5.1- Méthode de diffusion sur disques
(aromatogrammes)
Cet examen se fait de la même manière qu'un
antibiogramme où les antibiotiques sont remplacés par des
essences aromatiques, préalablement sélectionnées et
reconnues.
L'aromatogramme ou méthode par diffusion en milieu
gélosé ou encore méthode de disques est une technique
qualitative permettant de déterminer la sensibilité des
microorganismes vis-à-vis d'une substance réputée
antimicrobienne. Cette méthode repose sur le pouvoir migratoire des H.E.
à l'intérieur d'une boîte de Pétri, dans un milieu
nutritif solide (Mueller Hinton).
Le protocole de base des aromatogrammes qu'on a adopté
est celui qui a été proposé par le laboratoire de
microbiologie de l'École Polytechnique Fédérale de
LAUSANNE (Faculté Environnement Naturel, Architectural et Construit
Institut des infrastructures, des ressources et de l'environnement, Section
D'architecture, Suisse) auquel quelques modifications ont été
apportées.
L'ensemencement de l'inoculum de 1 mL est
réalisé en surface du milieu Mueller Hinton préalablement
coulé dans des boîtes de Pétri. Après 1/4 d'h, le
surplus est éliminé dans la hotte à flux laminaire
jusqu'à ce que la gélose soit sèche. Des disques
stériles (6 mm de ?; papier Wattman N°1) imprégnés d'une
quantité d'H.E. à l'état pur (5 ul) sont
déposés au centre des boîtes. Celles-ci sont ensuite
fermées et laissées diffuser pendant 20 mn puis incubées
à 37 °C pendant 24 h. Après incubation, l'absence de
croissance bactérienne exprimant une activité antimicrobienne se
traduit par un halo translucide autour du disque, de même couleur que la
gélose stérile et dont le diamètre est mesuré
à l'aide d'un pied à coulisse (exprimé en mm). Il est
important de noter que la quantité d'H.E. déposée sur le
disque varie selon les auteurs, excluant toute comparaison des valeurs des
diamètres mesurés (PIBIRI, 2006).
La sensibilité des différentes souches
vis-à-vis des H.E. étudiées est classée selon le
diamètre d'inhibition selon les critères suivants: non sensible
(-) pour ?<8 mm; sensible (+) pour j
compris 9-14 mm; très sensible (++) pour ?15-19 mm et
extrêmement sensible (+++) pour ?>20 mm (PONCE et
al., 2003). Des témoins négatifs utilisant uniquement des
disques placés sur gélose inoculée sans l'H.E.
Des disques d'antibiotiques Kanamycine, Pénicilline et
Ticarcilline de références médicales (GROUPE Glaxo Smith
Kline Algérie) ont été utilisés pour le
contrôle de l'activité des souches tests. Ce produit nous a servi
de standard de référence (témoins positifs) pour
l'évaluation de la sensibilité des microorganismes testés
dans ce travail et de s'assurer de l'état et de la conservation. Chaque
essai expérimental a été réalisé en
duplicata.
3.5.2- Microatmosphère (ou méthode en phase
vapeur)
La technique consiste à déposer des disques
stériles (6mm de ?; papier Wattman N°1) imbibés d'une
quantité déterminée (5 ul) d'H.E. au milieu des couvercles
des boîtes de Pétri et non en contact direct avec la gélose
ensemencée. Les boîtes sont fermées avec leurs
couvercles en bas puis, incubées à 37 °C
pendant 24 h. Après incubation, l'absence de la croissance
bactérienne se traduit par une zone translucide sur la gélose de
contour plus ou moins nette, à tendance circulaire lorsque le disque est
bien centré. Les résultats se lisent avec un pied à
coulisse et s'expriment par un diamètre en mm (cf. figure 14)
Les boîtes contrôles sont des boîtes de
Pétri ensemencées selon les conditions expérimentales.
3.5.3- Technique de diffusion en puits
L'activité antibactérienne des
différentes huiles diluées à 50 % a été
étudiée pour chaque souche bactérienne. À partir
d'une culture de 18 à 20 h (105-106 UFC/mL).
L'ensemencement de l'inoculum de 1 mL est réalisé en surface du
milieu Mueller Hinton préalablement coulé dans des boîtes
de Pétri. Après 15 mn, des puits ont été
découpés à l'aide de pipettes Pasteur
(l'extrémité épaisse de 6 mm de ?). Le fond des puits est
obturé par une goutte de gélose Mueller Hinton pour limiter la
diffusion des huiles sous la gélose. Ensuite, 50 ul de l'huile
diluée est distribuée dans chaque puits. Après diffusion
(? 20 mn), les cultures sont incubées dans des étuves à la
température de 37 °C pendant 24 h, et les auréoles
d'inhibition sont mesurées par un pied à coulisse. Le
diamètre du puits (8 mm) est inclus dans les tableaux des
résultats.
3.5.4- Nature de l'activité
antibactérienne (bactériostatique ou
bactéricide)
des huiles essentielles
La nature de l'activité de chacune des H.E.
testées a été déterminée par la
méthode de PIBIRI (2006). À partir des aromatogrammes de 48 h,
les zones translucides entourant les disques ont été
repiquées à l'aide d'une anse stérile dans des tubes
à essai contenant le milieu B.H.I.B. Les tubes sont ensuite
incubés à 37#177;1 °C pendant 24 h (cf. figure 22).
Un deuxième repiquage à l'aide d'une anse
stérile est effectué sur milieu Gélose Nutritive (en
stries) à partir des tubes à B.H.I.B. après 24 h
d'incubation.
Au bout de 24 h d'incubation à 37#177;1 °C, l'absence ou
présence de colonies est observée. L'absence de
développement bactérien indique un effet bactéricide de
l'H.E. en question, tandis que la présence de colonies
bactériennes nous renseigne sur un effet bactériostatique.
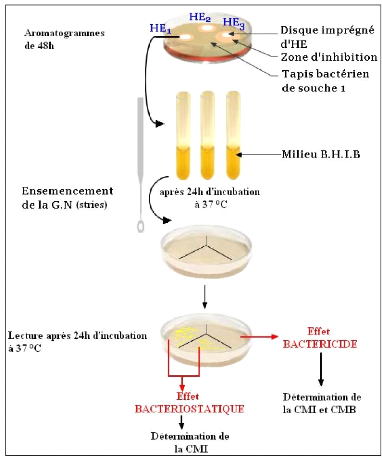
Fig. 22: Détermination de la nature de
l'activité antimicrobienne des H.E.
3.5.5- Détermination de la concentration minimale
inhibitrice (CMI) par méthode de dilutions en milieu solide
Même si les H.E. sont considérées comme
des additifs salubres (LAMBERT et al., 2001), leur utilisation est
souvent limitée par les critères organoleptiques de l'aliment.
Pour cette raison, il sera nécessaire de déterminer la CMI (c'est
à dire la plus faible concentration en huile capable d'inhiber toute
croissance bactérienne sans affecter la qualité sensorielle de
l'aliment), car selon l'effet recherché et les bactéries
ciblées, la concentration ne sera pas la même (CAILLET et LACROIX,
2007).
Le protocole de base utilisé dans notre
expérimentation est celui rapporté par BILLERBECK (2003). Les
modifications suivantes ont été apportées selon les
conditions expérimentales:
- L'intervalle des concentrations en H.E. choisi comporte 10
dilutions citées ci-dessus; - la gélose Trypcase-soja est
remplacé par la gélose Mueller Hinton;
- l'inoculation en surface de la gélose Mueller Hinton est
réalisée par 2 ul au lieu de 1ul pour bien visualiser le
développement microbien;
- pour ce qui est de la nature de l'activité
antibactérienne, la méthode citée
précédemment a été choisie.
La CMI est déterminée pour les huiles
présentant une activité antibactérienne intense sur les
souches bactériennes les plus sensibles. Le tableau suivant regroupe les
bactéries sélectionnées pour le calcul des CMI pour chaque
H.E. Uniquement les souches présentant une sensibilité accrue
sont retenues pour le calcul de la CMI (+++).
Tableau V : Répertoire des résultats
obtenus par la méthode des aromatogrammes.
|
Souche
H.E.
|
S. aureus
|
E. coli
|
S. flexneri
|
S.paratyphi A
|
B. cereus
|
|
Sarriette
|
++
|
+++
|
+++
|
+++
|
++
|
|
CG
|
+++
|
+++
|
++
|
+++
|
++
|
|
Eucalyptus
|
+++
|
+++
|
+++
|
-
|
-
|
+++ : très sensible ; ++ : sensible ;
- : résistante.
Du fait de la non miscibilité des H.E. à l'eau
et donc au milieu de culture, la mise en émulsion a été
réalisée grâce à une solution d'agar à 0,2 %
afin de favoriser le contact germe/composé. Chaque type d'huile est
dilué avec l'eau distillée stérile afin d'obtenir les
dilutions suivantes : 1/2 ; 1/4 (0,25) ; 1/5 (0,2) ; 1/10 (0,1) ; 1/20 (0,05) ;
1/40 (0,025) ; 1/50 (0,02) ; 1/60 (0,0166) ; 1/80 (0,0125) ; 1/100 (0,01).
Tableau VI : Valeurs des dilutions (ul d'HE/mL
d'eau).
|
Rapport
(HE/eau)
|
1/2
|
1/4
|
1/5
|
1/10
|
1/20
|
1/40
|
1/50
|
1/60
|
1/80
|
1/100
|
|
ul / mL
(HE/ eau)
|
1000
|
333,3
|
250
|
111,1
|
62,5
|
25,64
|
20,4
|
16,94
|
12,66
|
10,1
|
Pour pouvoir comparer les CMI de différents
micro-organismes, il est indispensable de travailler sur des cellules à
des stades de croissance (de 18 à 20 h d'incubation) et à des
concentrations similaires. Pour cela, les mesures de CMI doivent être
réalisées sur des biomasses microbiennes fraîches (en phase
exponentielle de croissance).
Les boîtes de Pétri sont remplies à
moitié par le milieu Mueller Hinton et laissées solidifier sous
la hôte à flux laminaire. Différentes concentrations d'H.E.
(cf. tableau VI) sont incorporées en masse dans le milieu de culture en
surfusion : 45 °C (Mueller Hinton Agar) avec les proportions suivantes : 1
mL de l'H.E. diluée et 3 mL du milieu en surfusion, puis on agite
convenablement les tubes à l'aide d'un vortex avant de les verser sur la
première couche. Après solidification, l'inoculation
bactérienne des géloses est effectuée en surface à
l'aide d'une micropipette automatique, sous forme de dépôts de 1
ul à partir de suspensions bactériennes de 105 ufc/mL.
L'ensemble est incubé à une T° de 37#177;1 °C pendant
24 h. La CMI est définie comme étant la plus faible concentration
en H.E. où on n'observe aucune croissance bactérienne.
| 


